首页 >
行业动态 > 【介孔MOF载药】:基于功能性分级介孔金属-有机骨架的光动力疗法及其伴随的离子干扰协同疗法
【介孔MOF载药】:基于功能性分级介孔金属-有机骨架的光动力疗法及其伴随的离子干扰协同疗法
摘要:
1)华东理工大学顾金楼组发表的文章(Small 2022, 18, 2204295)提出了一种基于分级介孔金属-有机骨架(HMMOFs)的纳米平台,将黑磷量子点(BPQDs)和介孔卟啉(TCPP)整合在一起,实现了在特定癌症区域内可控产生磷酸根离子(PAs),用于离子干扰疗法(IIT)。
2)HMMOFs的均一大孔能够选择性地包载超小且单分散的BPQDs。在微孔域中的TCPP能够在红光照射下有效产生单线态氧(1O2),不仅用于光动力疗法(PDT),还能触发邻近介孔域中BPQDs释放PAs,引发伴随的IIT。
3)所制备的纳米平台(BP@HMUiO-66-TCPP)表现出良好的生物相容性、生物降解性以及增强的协同治疗效果。在小鼠模型中,经14天治疗后,肿瘤抑制率高达约98.24%,且肿瘤体积仅为单一PDT治疗组的19.6%。该概念为精确可控的IIT提供了一种新的选择,有望提高抗肿瘤疗效。
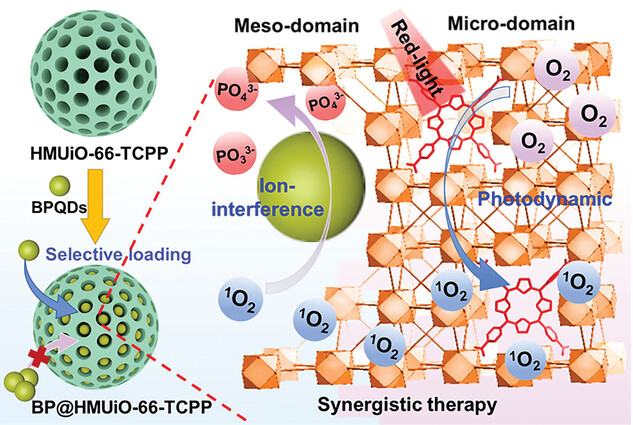
研究背景:
1)离子干扰疗法(IIT)是一种新兴的抗癌治疗方式,其机理在于异常分布的离子会扰乱细胞内离子稳态,导致细胞不可逆损伤甚至死亡。其中,磷酸根离子(PAs)被认为是最合适的IIT离子之一。
2)目前直接使用磷酸盐化合物进行IIT存在剂量高、循环时间短和非选择性细胞毒性等问题,需要探索理想的PAs供体来解决这些问题。
3)作者提出利用黑磷量子点(BPQDs)作为PAs供体,并将其与光敏剂TCPP整合在HMMOFs中。在光照条件下,TCPP产生的1O2能够诱导BPQDs降解释放PAs,实现PDT和IIT的协同疗效。HMMOFs的分级介孔结构能够分别负载BPQDs和TCPP,促进它们之间的协同作用。
实验部分:
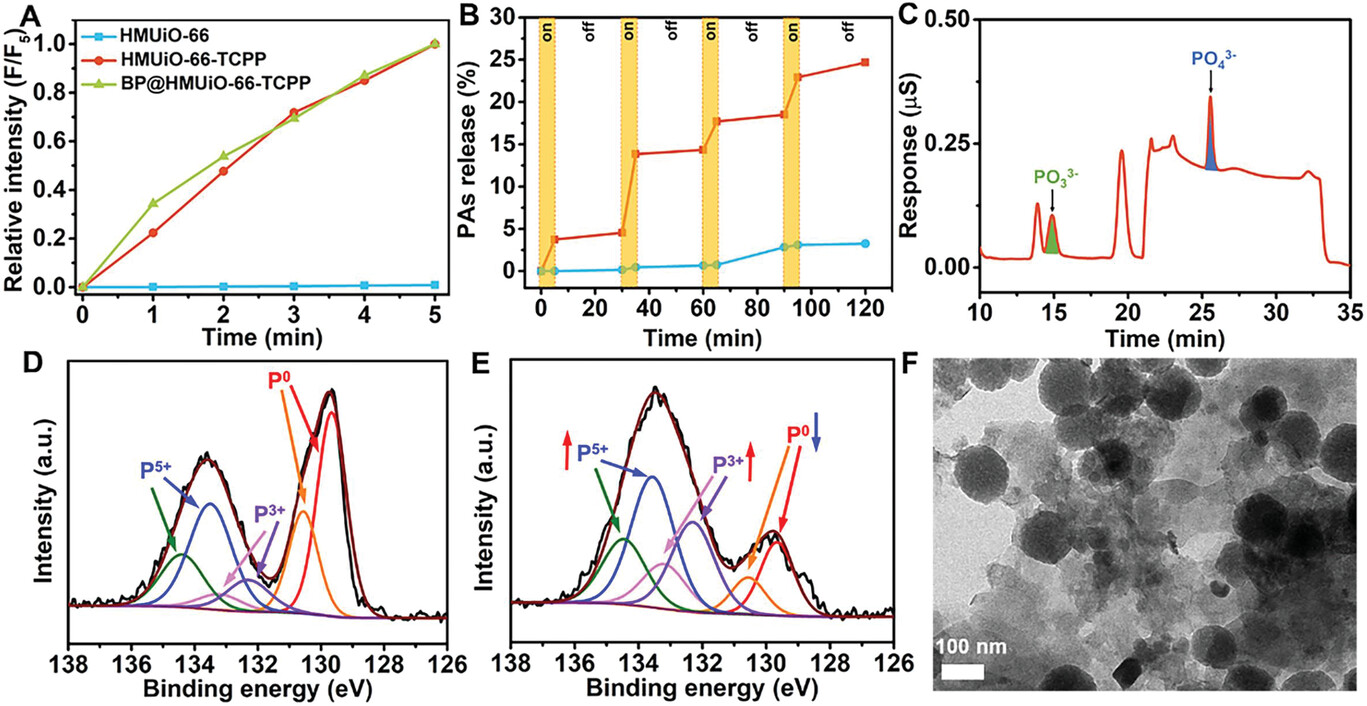
1)合成了具有均一大孔(约7nm)的HMUiO-66-TCPP,并通过后吸附法将BPQDs(平均尺寸7.2nm)负载到其介孔中,形成BP@HMUiO-66-TCPP纳米平台。
2)表征证实BPQDs被选择性地包载在HMUiO-66-TCPP的介孔中,而TCPP则分布在微孔域。
3)在660nm红光照射下,TCPP能够有效产生1O2,并快速扩散到介孔域中,诱导BPQDs降解释放PAs(主要为磷酸根和亚磷酸根离子)。该过程可在多个循环中被光控制开关。
4)BPQDs的降解过程通过XPS和TEM等手段得到证实。
分析测试:
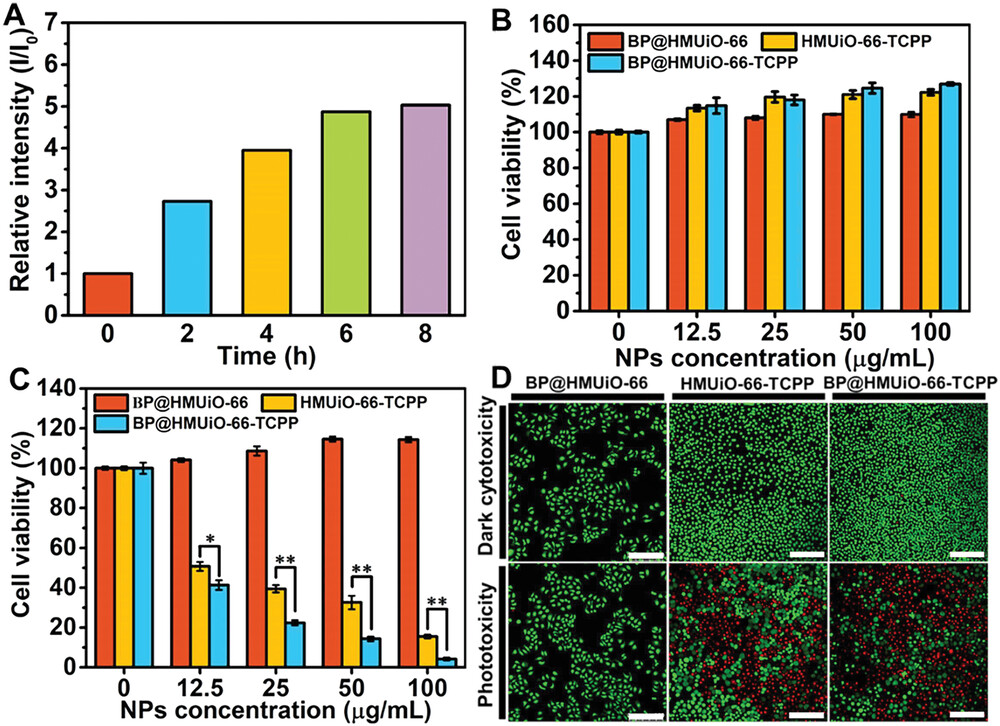
1)细胞实验表明,BP@HMUiO-66-TCPP在红光照射下对SMMC-7721肝癌细胞表现出明显的协同治疗效果,优于单一PDT或IIT疗效。
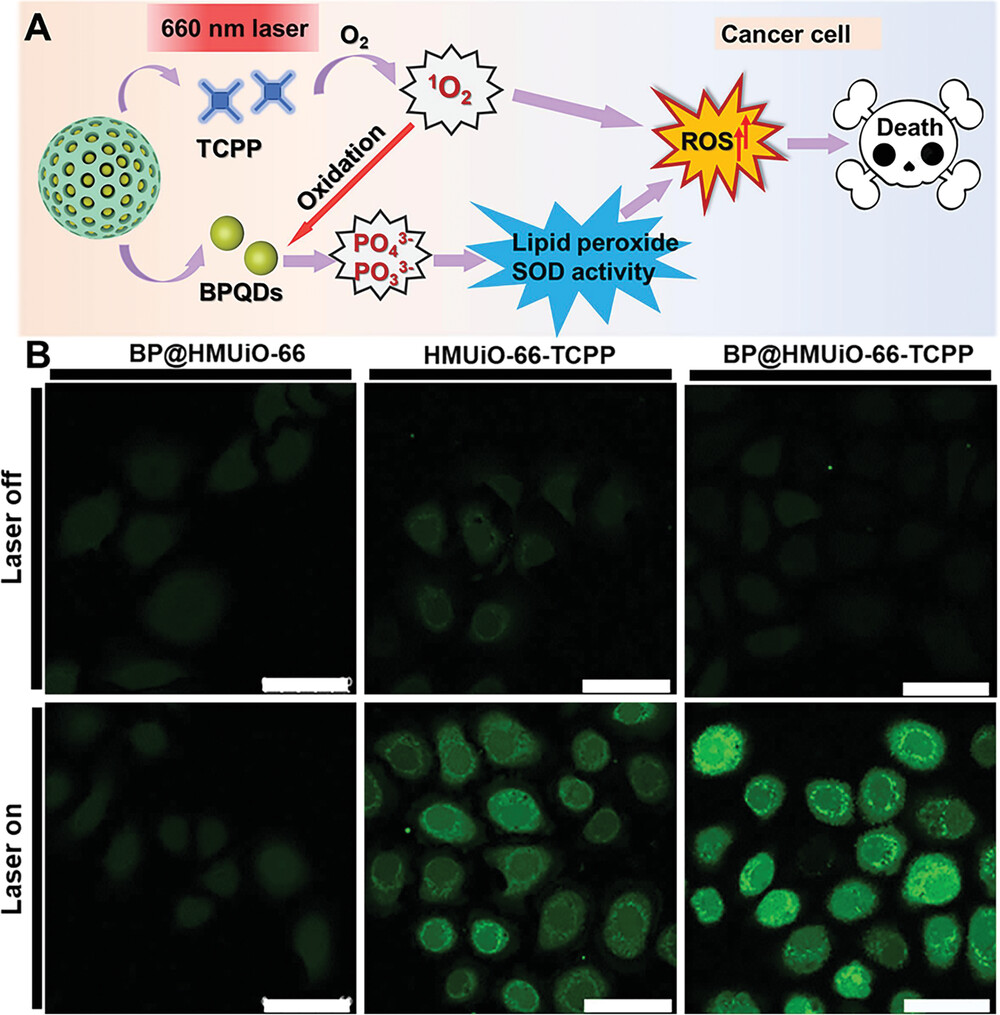
2)通过DCFH-DA探针检测发现,BP@HMUiO-66-TCPP组细胞内ROS水平明显升高,这是由TCPP产生的1O2以及PAs引发的一系列氧化反应所致。
3)体内小鼠实验显示,BP@HMUiO-66-TCPP能够有效富集在肿瘤部位,并在4h后达到最大富集量。经14天治疗后,肿瘤抑制率高达约98.24%,优于单一PDT(91.04%)或IIT(36.62%)疗效。
4)TUNEL染色结果证实,BP@HMUiO-66-TCPP组肿瘤细胞发生大量凋亡。
5)体内生物安全性评估(体重、H&E染色等)表明该纳米平台具有良好的生物相容性和生物降解性。
总结:
1)该工作成功开发了一种基于HMMOFs的纳米平台,实现了光控制的PDT和IIT协同疗效。该平台表现出增强的抗肿瘤活性、良好的生物相容性和生物降解性,为精确可控的IIT提供了新的选择。
2)未来可以进一步优化纳米平台的结构和组分,提高疗效和靶向性;探索将该概念扩展到其他IIT离子体系;深入研究协同作用机理等。
Photodynamic and Its Concomitant Ion-Interference Synergistic Therapies Based on Functional Hierarchically Mesoporous MOFs
文章作者:Miao He, Ke Li, Jian Yang, Qinghua Wang, Jinlou Gu
DOI:10.1002/smll.202204295
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/smll.202204295
本文为科研用户原创分享上传用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权请联系修改、删除修改。未经允许第三方不得复制转载。



