首页 >
行业动态 > 【MOF载药】:基于具有高效抑制细菌生物膜能力的双金属分级大孔MOFs的DNase模拟物
【MOF载药】:基于具有高效抑制细菌生物膜能力的双金属分级大孔MOFs的DNase模拟物
摘要:
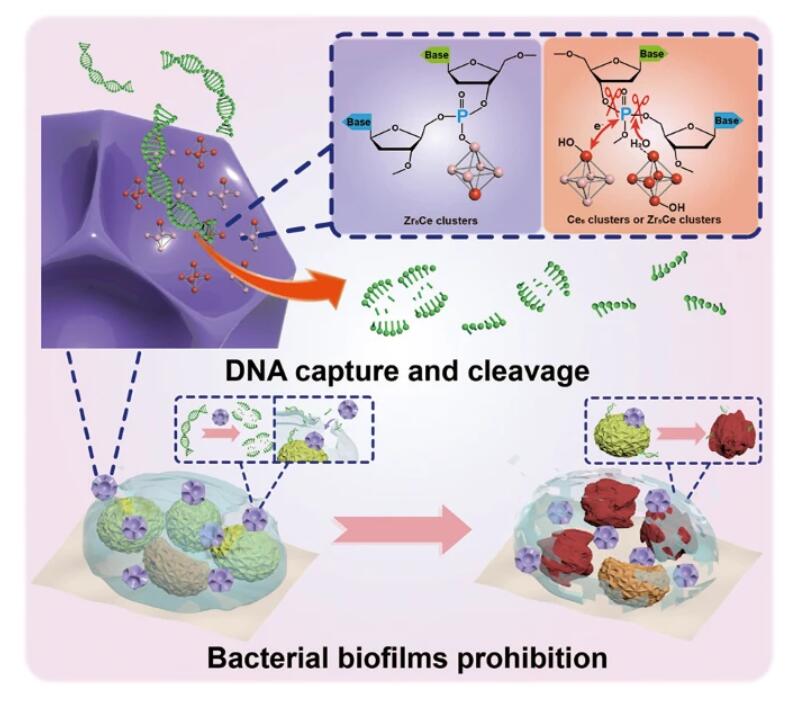
华东理工大学顾金楼团队发表的文章(Sci China Mater 2024, 67, 343–354)成功构建了具有切割DNA能力的双金属分级大孔金属-有机框架(MOFs)(HMUiO-66(Zr/Ce)),用于高效破坏生物膜,从而抑制细菌生长。通过系统调节Zr/Ce的投料比,可以将其粒径最小化至约150 nm,并可在0至69%的宽摩尔范围内精确调控引入HMUiO-66(Zr/Ce)中的Zr量。所开发的HMUiO-66(Zr/Ce)具有独特的化学和热稳定性以及丰富的暴露Lewis酸位点。得益于其开放的大孔结构和可接近的活性位点,它们表现出优异的DNase模拟活性。双金属MOFs中存在的丰富Zr-OH位点可有效捕获核酸,而相邻的Ce-OH基团形成亲核攻击磷-氧键,协同放大DNA的水解速率。这种独特的DNA切割能力使开发的HMUiO-66(Zr/Ce)能够作为纳米药物用于切割交联的胞外DNA并根除细菌生物膜。在此基础上,我们设计了一种仿生HMUiO-66(Zr/Ce)/聚偏氟乙烯(PVDF)膜,可明显抑制细菌的粘附和定植,预示着它们在抗菌治疗和医疗器械中的广泛应用潜力。
研究背景:
(1) 细菌生物膜的积累对人类健康构成严重威胁,使其有效破坏和根除具有重要意义,但面临巨大挑战。
(2) 其他学者提出了一些解决方案,如利用脱氧核糖核酸酶(DNase)催化水解DNA,其中金属离子在激活DNA中的P-O键并触发其断裂方面起关键作用。然而,天然DNase不仅成本高,而且易受环境因素影响,限制了其作为有效治疗剂抗生物膜的实际可行性。
(3) 本文作者在其他人工作的基础上,通过模拟DNase的催化机制和分子结构,提出开发高效DNase模拟物的思路。他们设计并合成了具有可调Zr/Ce比例的双金属分级大孔MOFs,将Zr4+的优异化学稳定性和Ce4+的强亲核进攻能力结合,协同促进DNA水解,增强了抗菌生物膜活性。
实验部分:
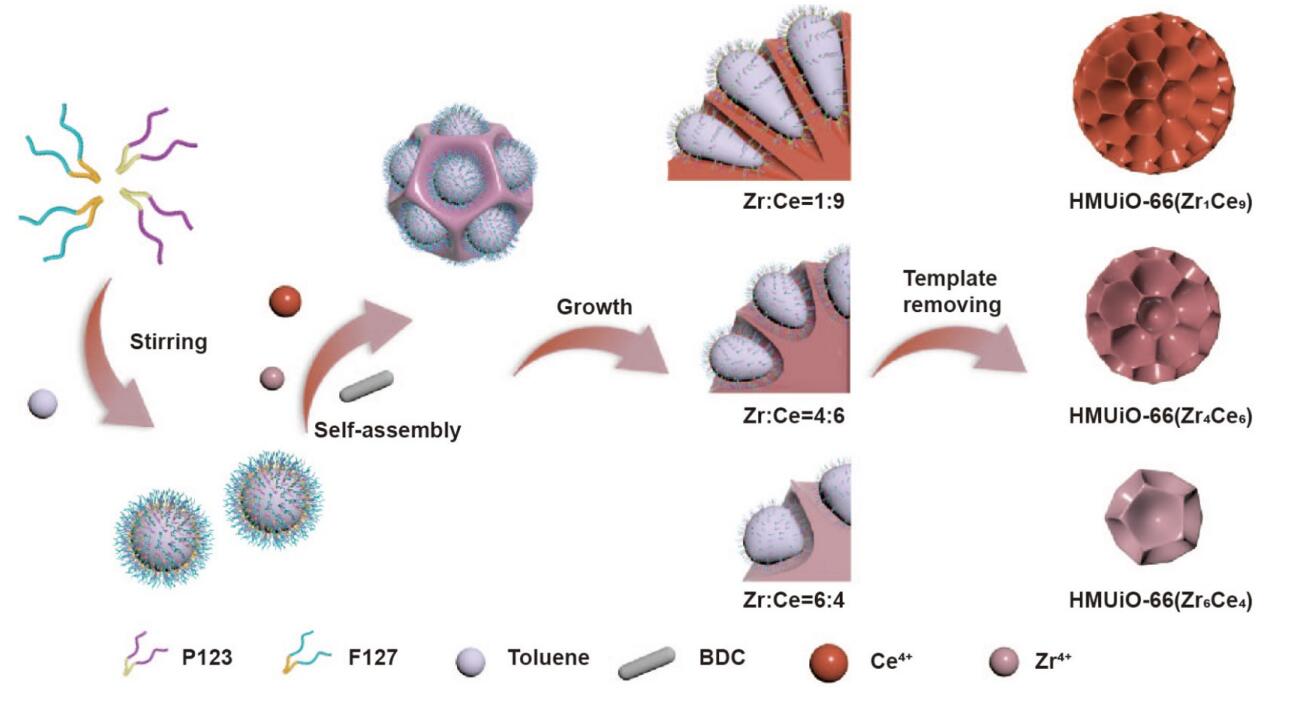
(1) 合成了一系列不同Zr/Ce比例的双金属分级大孔HMUiO-66(Zr/Ce)。通过系统调节Zr/Ce前驱体的投料比和HNO3用量,实现了对Zr掺杂量(0-69%)和MOF粒径(约150 nm-1 μm)的精确调控。
(2) 利用XRD、SEM、TEM、XPS、FT-IR、TGA等手段系统表征了样品的结构、形貌、组成和稳定性。结果表明,所制备的HMUiO-66(Zr/Ce)具有UiO-66拓扑结构,元素分布均匀,化学和热稳定性优异,缺陷位点和Lewis酸性明显增强。
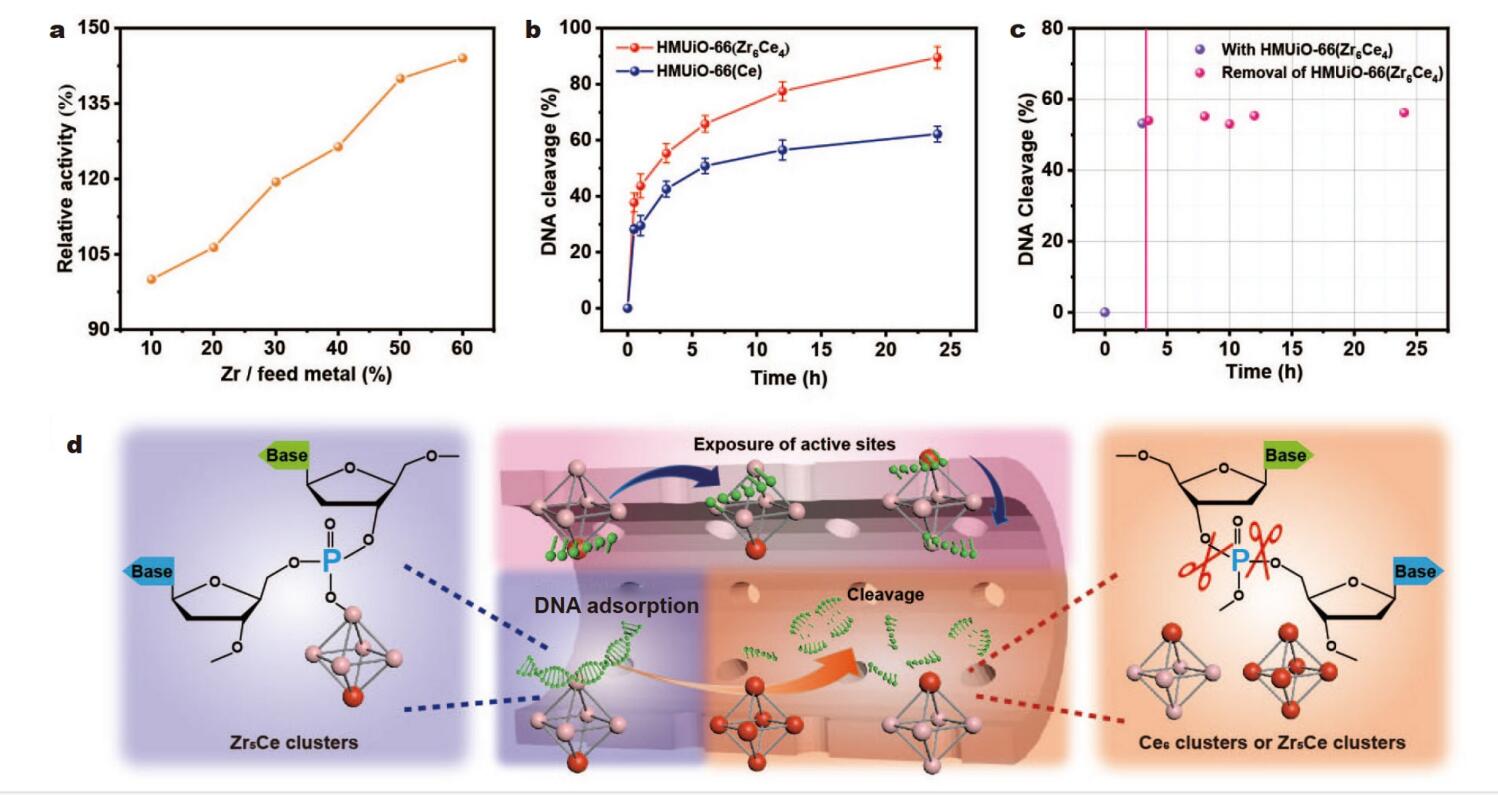
(3) 以DNA为底物,考察了一系列HMUiO-66(Zr/Ce)的水解活性。结果显示,随Zr含量增加,DNA切割效率逐步提高,Zr含量最高的HMUiO-66(Zr6Ce4)的DNA水解活性比HMUiO-66(Ce)提高47%,且具有更持久的催化性能。
(4) 将HMUiO-66(Zr6Ce4)作为纳米药物,利用其优异的DNA切割能力,高效破坏已形成的细菌生物膜,抑制细菌生长。此外,还将其负载于PVDF基底,制备成柔性膜,可有效防止细菌在材料表面的粘附和生物膜形成。
上述实验结果表明,引入Zr可显著提高Ce基MOF的DNA水解活性和抗菌生物膜效果,实现了优于单一金属位点MOF的突破。
分析测试:
(1) XRD结果表明,不同Zr/Ce比例的HMUiO-66(Zr/Ce)均具有与UiO-66(Ce)相似的拓扑结构。随Zr含量增加,(111)和(002)晶面的衍射峰向高角度方向移动,证实了Zr的成功引入。
(2) N2吸附测试结果显示,所有MOF样品均具有Type I等温线,随Zr含量增加,比表面积和孔体积略有增大(表S1)。
(3) XPS分析发现,随Zr含量从0增至69%,Zr 3d结合能变化较小,而Ce 3d结合能明显移动,表明Ce的配位环境发生显著变化,暗示形成了Ce-Zr异核团簇。
(4) TGA结果表明,Zr含量最高的HMUiO-66(Zr6Ce4)的分解温度高达约380°C,热稳定性最佳。
(5) FT-IR光谱中,HMUiO-66(Zr6Ce4)在2350和2315 cm-1处出现的峰强度明显高于HMUiO-66(Ce),证实Zr掺杂引入了更多Lewis酸性位点。
(6) 动力学实验表明,HMUiO-66(Zr6Ce4)对DNA的切割反应在3h后仍能持续进行,而HMUiO-66(Ce)的反应速率在3h后显著降低,表明Zr-Ce双金属位点具有更持久的DNA水解活性。
上述系统的表征和分析揭示了Zr-Ce双金属团簇的形成及其协同增强DNA水解活性的机制,为设计高效抗菌生物膜材料提供了重要依据。
总结:
(1) 成功构建了一系列不同Zr/Ce比例的双金属分级大孔HMUiO-66(Zr/Ce),实现了对其组成、粒径和缺陷的精确调控。
(2) Zr-Ce双金属MOF中Zr-OH和Ce-OH位点的协同作用,显著提高了DNA水解速率和持续性。
(3) 基于HMUiO-66(Zr/Ce)优异的DNA切割能力,将其用作纳米药物和柔性膜涂层,可高效破坏细菌生物膜,抑制细菌粘附和定植。
(4) 本工作揭示了双金属组分和开放大孔结构在提升MOF的DNase模拟活性和抗菌性能方面的重要作用,为开发新型抗菌生物膜材料提供了新思路。
(5) HMUiO-66(Zr/Ce)在抗菌治疗和医疗器械领域具有广阔的应用前景。

展望:
(1) 进一步研究该材料应用于柔性膜的构筑,涉及的力学性能、生物相容性等问题。
(2) 建议系统开展材料的性能评价和动物实验,为其在生物医学领域的实际应用奠定基础。
(3) 本文提出的双金属协同策略对于其他类型MOF的功能化改性具有一定启发意义,建议拓展到更多MOF体系,并探索其在环境修复、生物传感等领域的应用。
DNase-mimetics based on bimetallic hierarchically macroporous MOFs for the efficient inhibition of bacterial biofilm
文章作者:Fan Xia (夏凡), Ke Li (李可), Jian Yang (杨健), Jingwen Chen (陈婧雯), Ximeng Liu (刘熙濛), Ming Gong (龚鸣) & Jinlou Gu (顾金楼)
DOI:10.1007/s40843-023-2687-7
文章链接:https://link.springer.com/article/10.1007/s40843-023-2687-7



