首页 >
行业动态 > 【MOF载药】:基于金属-有机框架的粘膜黏附纳米药物,用于幽门螺杆菌的靶向根除、炎症调节和肠道菌群保护
【MOF载药】:基于金属-有机框架的粘膜黏附纳米药物,用于幽门螺杆菌的靶向根除、炎症调节和肠道菌群保护
摘要:
南昌大学王小磊老师等报道的本篇文章中(Small 2024, 2308286)研究了针对H. pylori感染的新型治疗策略,制备了CS-Se修饰的Bi—MOF@CS-Se纳米药物,发现了Bi—MOF@CS-Se对H. pylori和耐药菌株表现出优异的抗菌效果,同时能缓解炎症和氧化应激,说明Bi—MOF@CS-Se纳米药物在治疗H. pylori感染方面表现出很好的潜力

研究背景:
1)H. pylori感染治疗存在挑战,主要是耐药菌株的出现,传统的抗菌药物治疗存在局限性,如对胃粘膜的渗透性差等。
2)本文通过功能化Bi—MOF@CS-Se纳米药物来解决这些问题,具有针对性、抗菌、抗炎和抗氧化应激的特性。
实验部分:
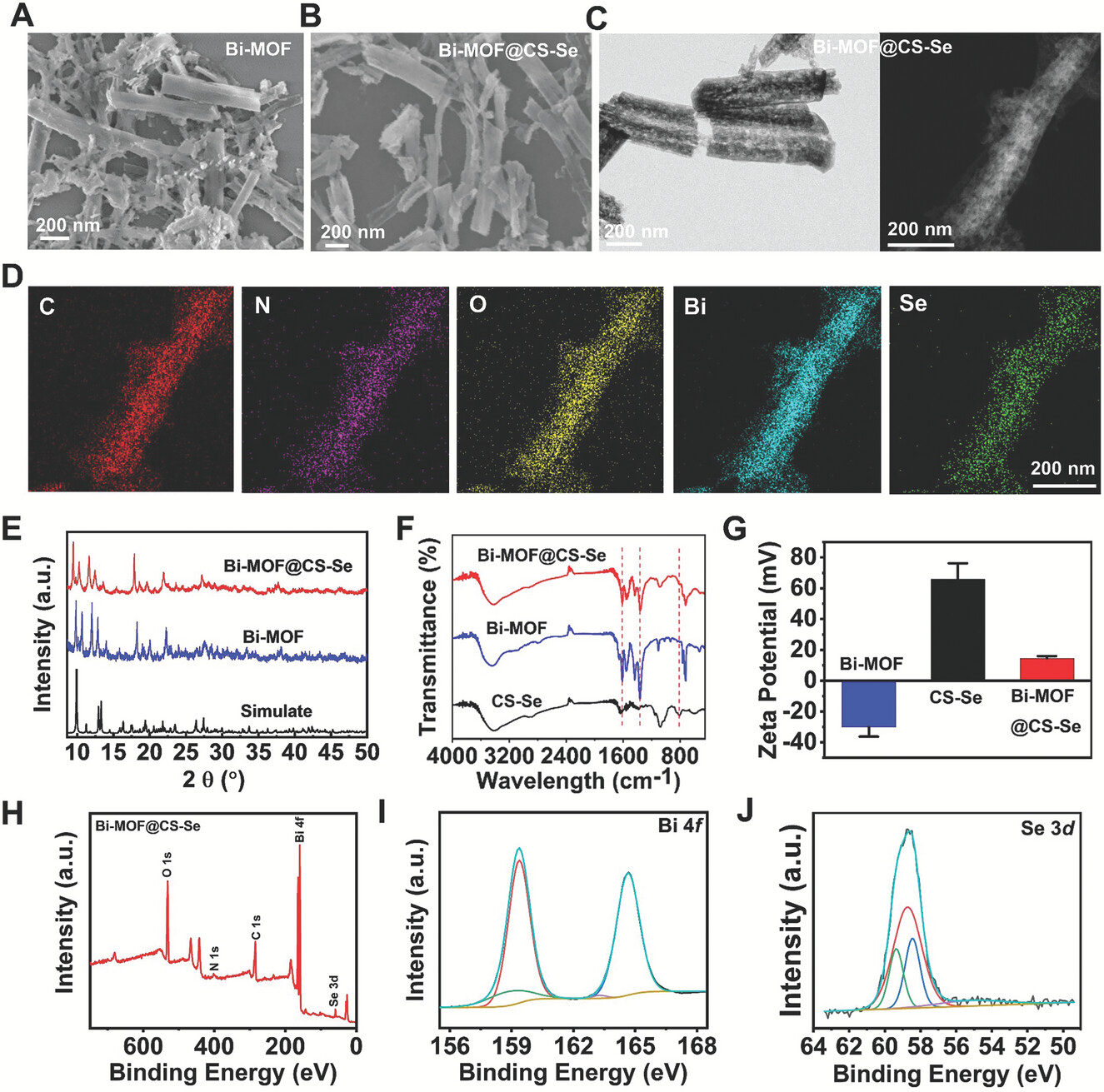
1)合成了Bi-MOF并进行了表征,用SEM展示了其棒状结构,然后制备了CS-Se聚合物以实现Bi-MOF的胃滞留和抗炎功能。FTIR光谱显示CS-Se的松散结构和良好水溶性。进一步将Bi-MOF表面修饰为CS-Se,通过SEM和能谱分析显示了Bi和Se的分布和含量。
2)XRD确定了Bi-MOF@CS-Se的晶体结构与纯Bi-MOF相匹配。FTIR显示Bi-MOF@CS-Se的C─O和Se═O键的拉伸振动峰。XPS分析确定Bi和Se元素存在三价和四价形式。Zeta电位分析显示Bi-MOF@CS-Se具有正电荷。
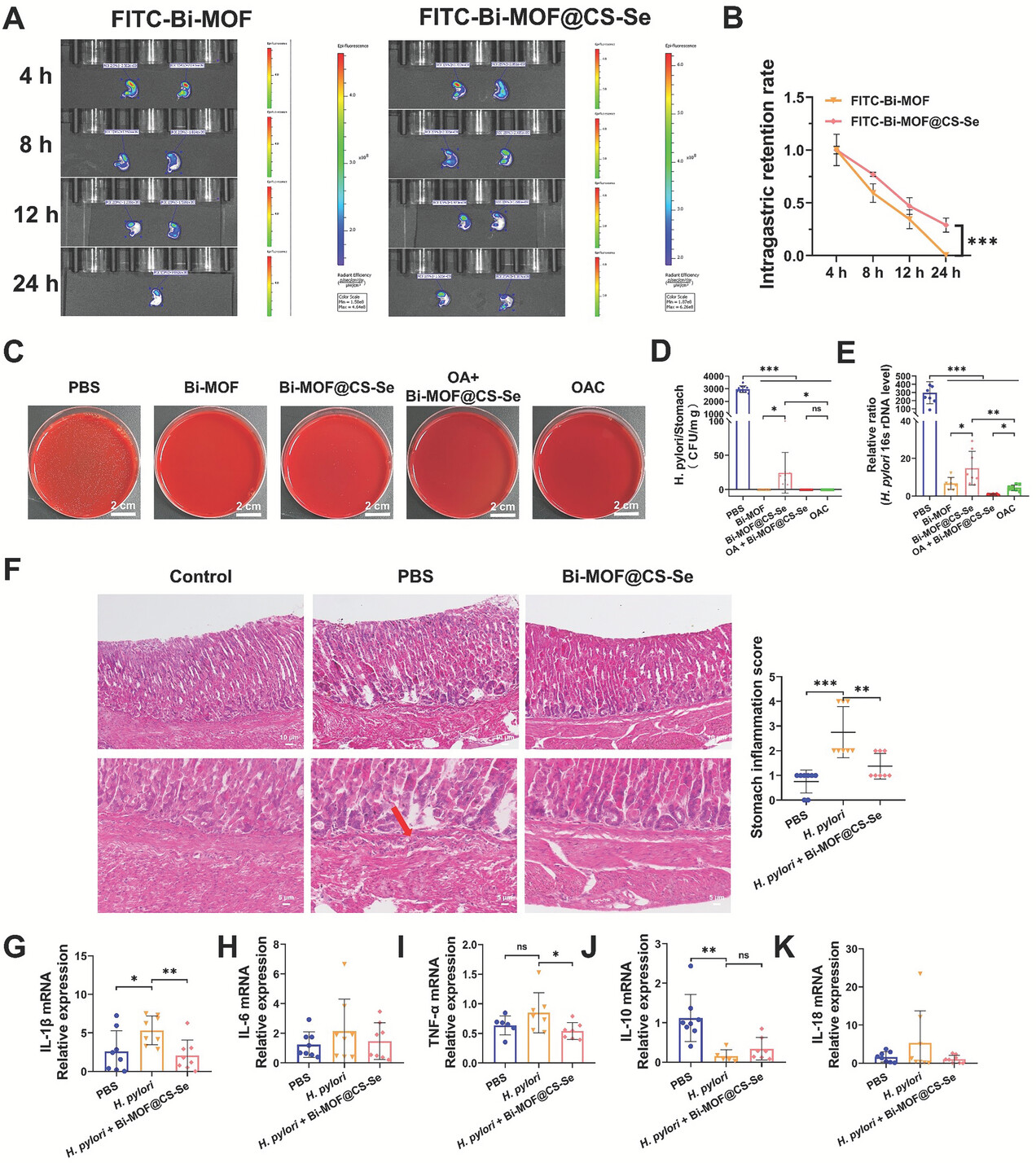
3)在酸性环境下,Bi-MOF@CS-Se的CS-Se套Coating在模拟胃液中解体,暴露Bi-MOF并促进Bi3+的释放。Bi-MOF@CS-Se表现出优异的在酸性条件下的抗H. pylori活性。
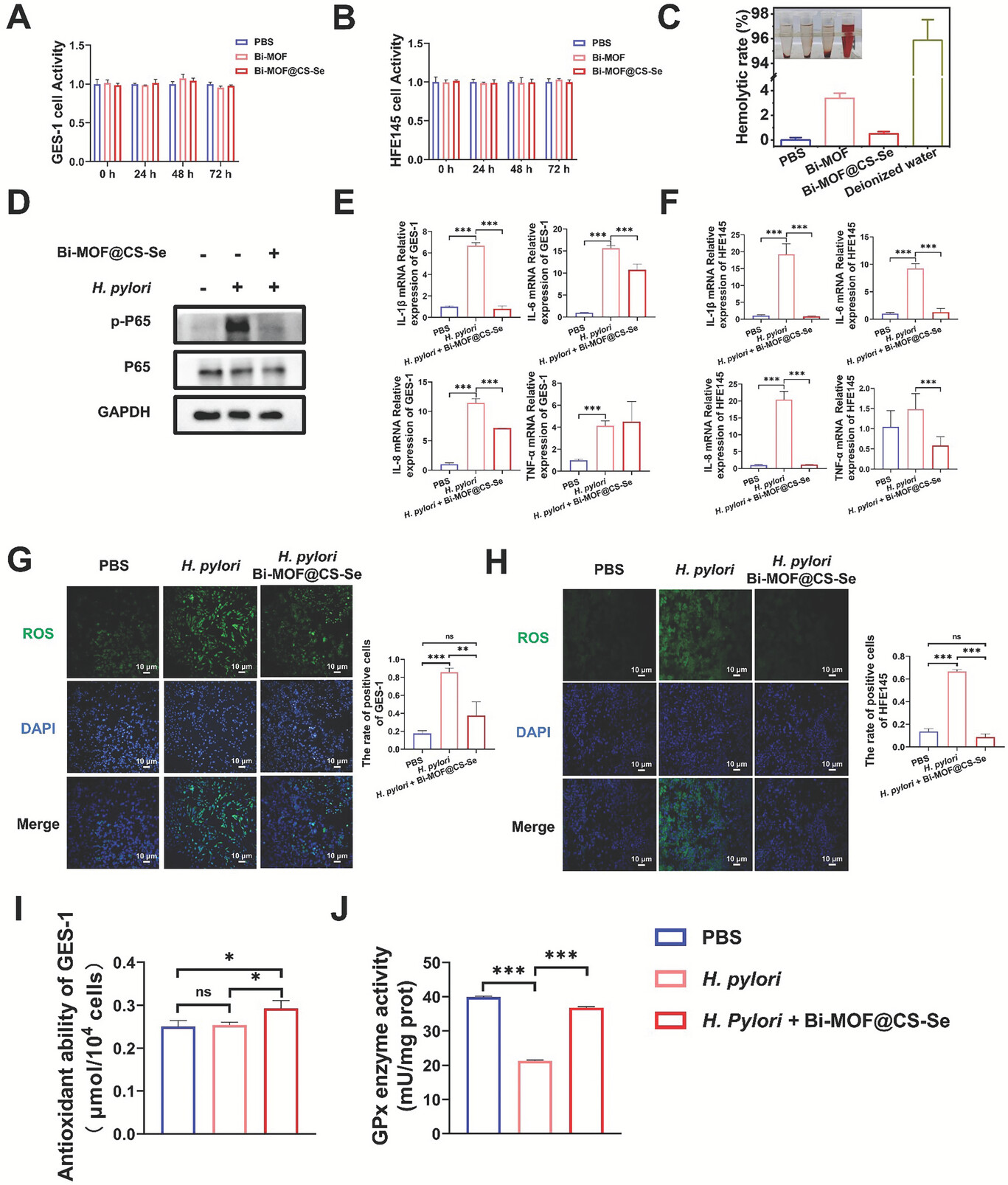
4)在体外实验证实Bi-MOF@CS-Se对降低H. pylori感染引起的细胞炎症和ROS积累具有显著作用。通过对H. pylori细胞的能量代谢、细胞膜通透性和氧化还原平衡进行测定,证明了Bi-MOF@CS-Se抗H. pylori的机制。
分析测试:
1)通过细菌培养实验证实Bi-MOF对H. pylori的杀灭作用,MBC为62.5 µg mL−1,MIC为31.25 µg mL−1。同时,对临床耐药菌株H. pylori进行处理后,Bi-MOF表现出显著的抗H. pylori活性,与氨苄青霉素相媲美。
2)体内实验表明,Bi-MOF@CS-Se在消除H. pylori和减轻炎症方面表现出优越性,以及对临床耐药菌株H. pylori的杀灭作用。同时,Bi-MOF@CS-Se对炎症因子的调节表现出卓越的功效。
3)通过肠道微生物组的16s rRNA测序技术检测,在治疗小鼠中,Bi-MOF@CS-Se对肠道微生态的多样性和结构没有显著影响。同时,在体外实验中,Bi-MOF@CS-Se对肠道有益菌没有毒副作用。
4)生物安全性实验显示,Bi-MOF@CS-Se在体内具有良好的兼容性,对肝肾功能无显著影响。
结论:
Bi—MOF@CS-Se纳米药物在治疗H. pylori感染方面表现出了很好的效果,通过调节炎症因子和清除过多ROS来缓解炎症和氧化应激,未来研究方向可能包括更深入的体内实验和临床试验。

展望:
1)可进一步探究该纳米药物的生物降解和代谢动力学
2)可以考虑在不同动物模型中测试该药物的安全性和有效性
3)未来研究可以关注该纳米药物的长期稳定性和对抗多种H. pylori菌株的效果。
Metal-Organic Framework Based Mucoadhesive Nanodrugs for Multifunction Helicobacter Pylori Targeted Eradication, Inflammation Regulation and Gut Flora Protection
文章作者:Yanan Zhou, Wei Zhang, Cong He, Chunxi Shu, Xinbo Xu, Huan Wang, Xiao Fei, Nianshuang Li, Yi Hu, Chuan Xie, Nonghua Lu, Xiaolei Wang, Yin Zhu
DOI:10.1002/smll.202308286
文章链接:https://doi.org/10.1002/smll.202308286




