首页 >
行业动态 > 【MOF载酶】一种包囊酶MOF@MOF用于检测HeLa细胞线粒体释放的超氧阴离子H2O2的纳米复合材料
【MOF载酶】一种包囊酶MOF@MOF用于检测HeLa细胞线粒体释放的超氧阴离子H2O2的纳米复合材料
摘要:
河南大学刘小强和Macquarie University的Danny K.Y. Wong老师等报道的本篇文章(Small Methods 2024, 2401070)中开发了一种辣根过氧化酶(HRP)包覆的金属有机框架(MOF)@MOF纳米复合物,用于检测活细胞HeLa线粒体释放的超氧阴离子(O∗−2)经歧化反应产生的过氧化氢(H2O2)。首先,通过将HRP-聚丙烯酸簇结合到具有类过氧化物酶活性的介孔Cu/Co-1,4-苯二甲酸(BDC)MOF平台上,避免了HRP与MOF金属离子的直接接触,保持了HRP的结构和活性。然后,采用Cu/Co-BDC(HRP)@1,3,5-苯三甲酸(BTC)核壳MOF/MOF结构作为HRP的保护基质。接着,通过超薄多孔碳壳(UPCS)提高MOF@MOF的电导率。所制备的Cu/Co-BDC(HRP)@BTC|UPCS传感平台对H2O2的检测展现出0.05–1 μM和1–1000 μM的两个线性范围,灵敏度分别为172 mA mM−1 cm−2和1.63 mA mM−1 cm−2,检测限为0.057 μM,并展现出35天的良好选择性和稳定性。通过使用线粒体复合体抑制剂处理后,通过该传感平台进行的安培测定结果证实了线粒体中的复合体I和III是电子传递链中主要的电子泄漏位点。因此,该传感平台为预测和开发针对线粒体异常引起的某些氧化应激疾病的治疗提供了工具。
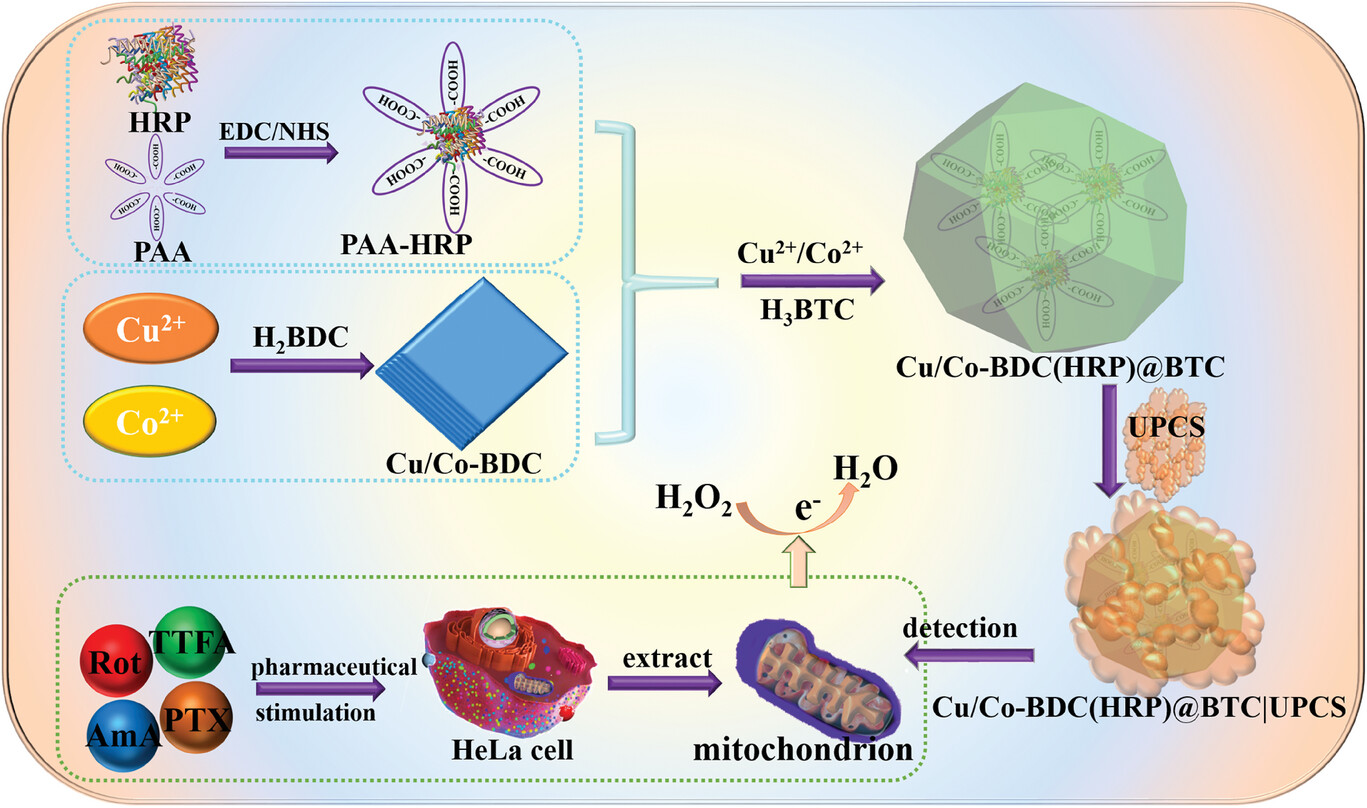
研究背景:
1) 线粒体在氧化磷酸化过程中可能会泄露电子,与氧气反应生成超氧阴离子和过氧化氢等活性氧物质,这些物质在过量时会引起蛋白质的非特异性氧化,导致生物大分子的可逆/不可逆损伤,最终可能导致氧化应激疾病,如阿尔茨海默病、癌症等。
2) 以往研究中,通常使用荧光法检测超氧阴离子,但该方法存在制备荧光探针繁琐、荧光探针穿透细胞或线粒体膜导致的检测误差等问题。
3) 作者开发了一种基于电化学还原酶促产生的H2O2的间接检测方法,避免了荧光法的不足,实现了对线粒体H2O2的快速、灵敏、准确、实时检测。

实验部分:
1. 合成HRP-聚丙烯酸(PAA)簇:
1) 将一定量的辣根过氧化氢酶(HRP)和聚丙烯酸(PAA)溶解在0.1 M的磷酸盐缓冲液(PBS, pH 7.4)中。
2) 使用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)作为交联剂,在4°C下反应过夜。
3) 通过透析法去除未反应的EDC、NHS和PAA,获得HRP-PAA簇。
2. 制备Cu/Co-BDC(HRP)@BTC核壳结构:
1) 将合成的HRP-PAA簇与Cu/Co-BDC MOF混合,在室温下搅拌24小时。
2) 通过离心和洗涤去除未结合的HRP-PAA,得到Cu/Co-BDC(HRP)@BTC核壳结构。
3. 合成超薄多孔碳壳(UPCS):
1) 将蔗糖和活性碳源溶解在乙醇中,加入一定量的催化剂,如硫酸。
2) 将混合物在120°C下老化处理,随后在350°C下碳化,得到UPCS。
4. 制备Cu/Co-BDC(HRP)@BTC|UPCS纳米复合物:
1) 将Cu/Co-BDC(HRP)@BTC与UPCS混合,在80°C下加热处理以促进UPCS在MOF表面的沉积。
2) 通过离心和洗涤去除多余的UPCS,得到最终的Cu/Co-BDC(HRP)@BTC|UPCS纳米复合物。
5. 电化学性能测试:
1) 将Cu/Co-BDC(HRP)@BTC|UPCS纳米复合物均匀涂覆在玻碳电极(GCE)表面。
2) 使用0.1 M PBS (pH 7.4)作为电解液,通过循环伏安法(CV)测试其对H2O2的电催化活性。
3) 在含有不同浓度H2O2的PBS溶液中进行CV测试,记录电流响应。
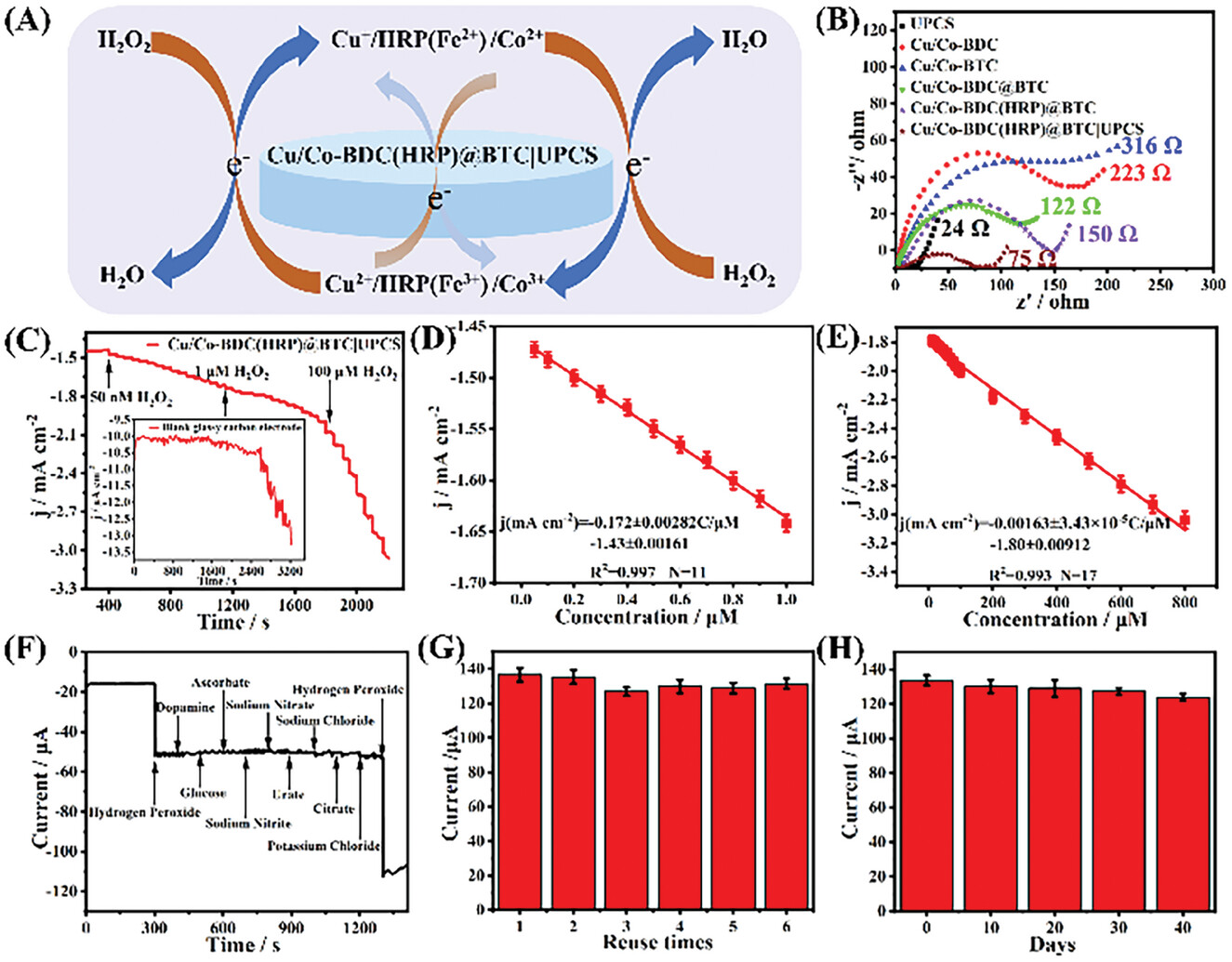
6. 电子转移特性研究:
1) 采用电化学阻抗谱(EIS)在0.2 V下测试不同MOF材料的电子转移阻力(Ret)。
2) 通过Nyquist图分析,得到不同材料的电子转移阻力值。
7. 实际应用测试:
1) 将HeLa细胞线粒体与不同浓度的线粒体复合体抑制剂共培养。
2) 使用Cu/Co-BDC(HRP)@BTC|UPCS修饰的电极进行安培法测试,检测线粒体释放的H2O2。
分析测试:
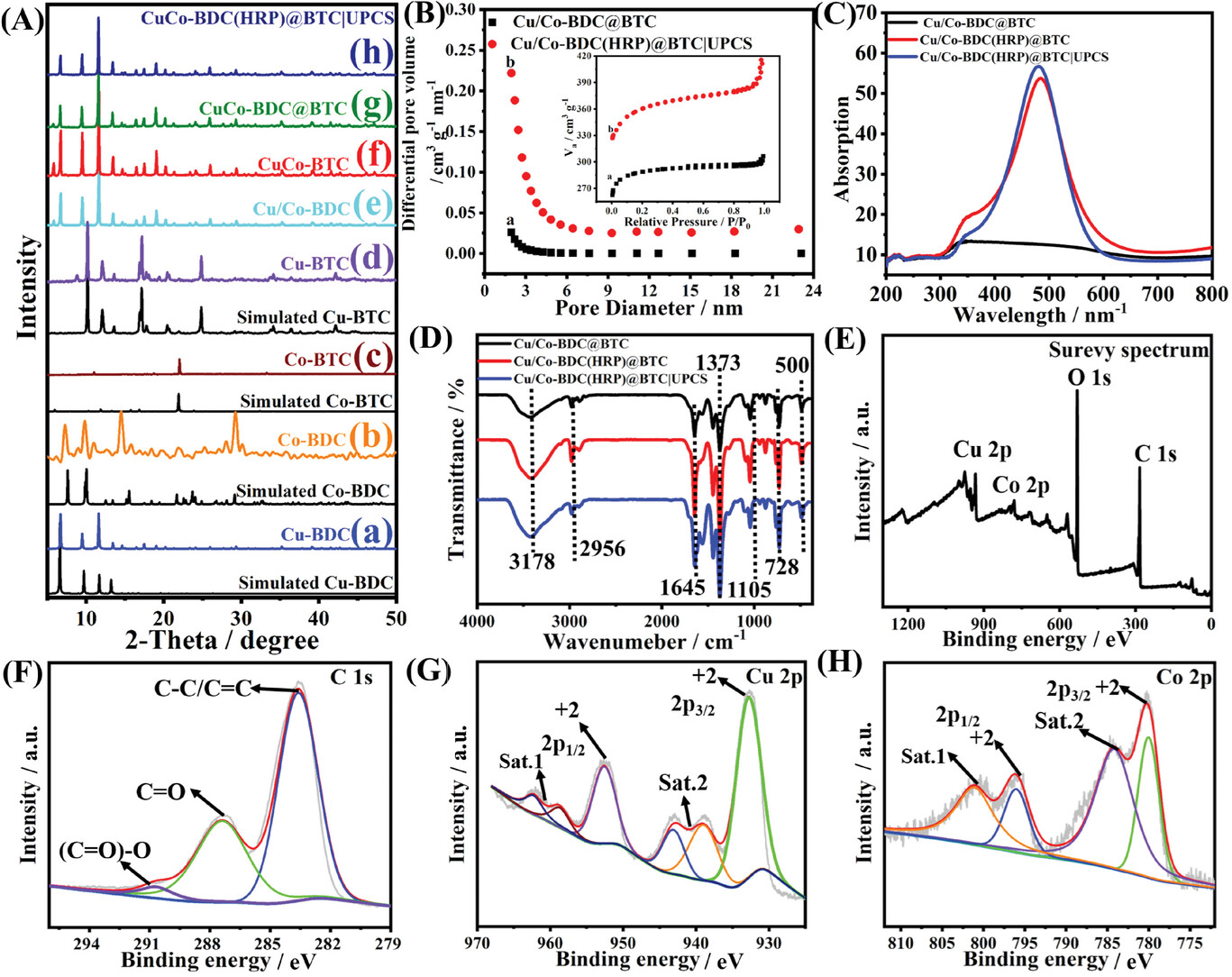
1. 样品形态学表征:
- 使用Zeiss场发射扫描电子显微镜(SEM)和透射电子显微镜(TEM)检查样品的形态和结构。
- SEM结果显示Cu/Co-BDC(HRP)@BTC|UPCS具有多面体形态,表面覆盖着UPCS层。
2. 晶体结构分析:
- 通过X射线衍射(XRD)分析MOF材料的晶体结构和相组成。
- XRD结果显示Cu/Co-BDC(HRP)@BTC|UPCS保留了原始MOF的结构特征。
3. 比表面积和孔隙结构分析:
- 在77 K下通过N2吸附-脱附等温线获取样品的比表面积和孔径分布。
- Cu/Co-BDC@BTC和Cu/Co-BDC(HRP)@BTC|UPCS的比表面积分别为877 m2 g−1和1108 m2 g−1,孔径分别为2.16 nm和2.38 nm。
4. 紫外-可见(UV-vis)光谱分析:
- 通过固体UV-vis光谱分析HRP在MOF@MOF结构中的封装情况。
- UV-vis光谱显示Cu/Co-BDC(HRP)@BTC|UPCS的Soret吸收带在约450 nm处。
5. 红外光谱(FT-IR)分析:
- 通过FT-IR分析MOF@MOF结构中有机配体和HRP的特征振动。
- FT-IR结果显示Cu/Co-BDC(HRP)@BTC|UPCS的特征峰与原始MOF一致,但HRP的加入导致峰强度减弱。
6. X射线光电子能谱(XPS)分析:
- 通过XPS分析MOF@MOF结构中Cu和Co的氧化态以及元素组成。
- XPS结果显示Cu/Co-BDC(HRP)@BTC|UPCS中Cu和Co的存在形式为Cu(II)和Co(II)。
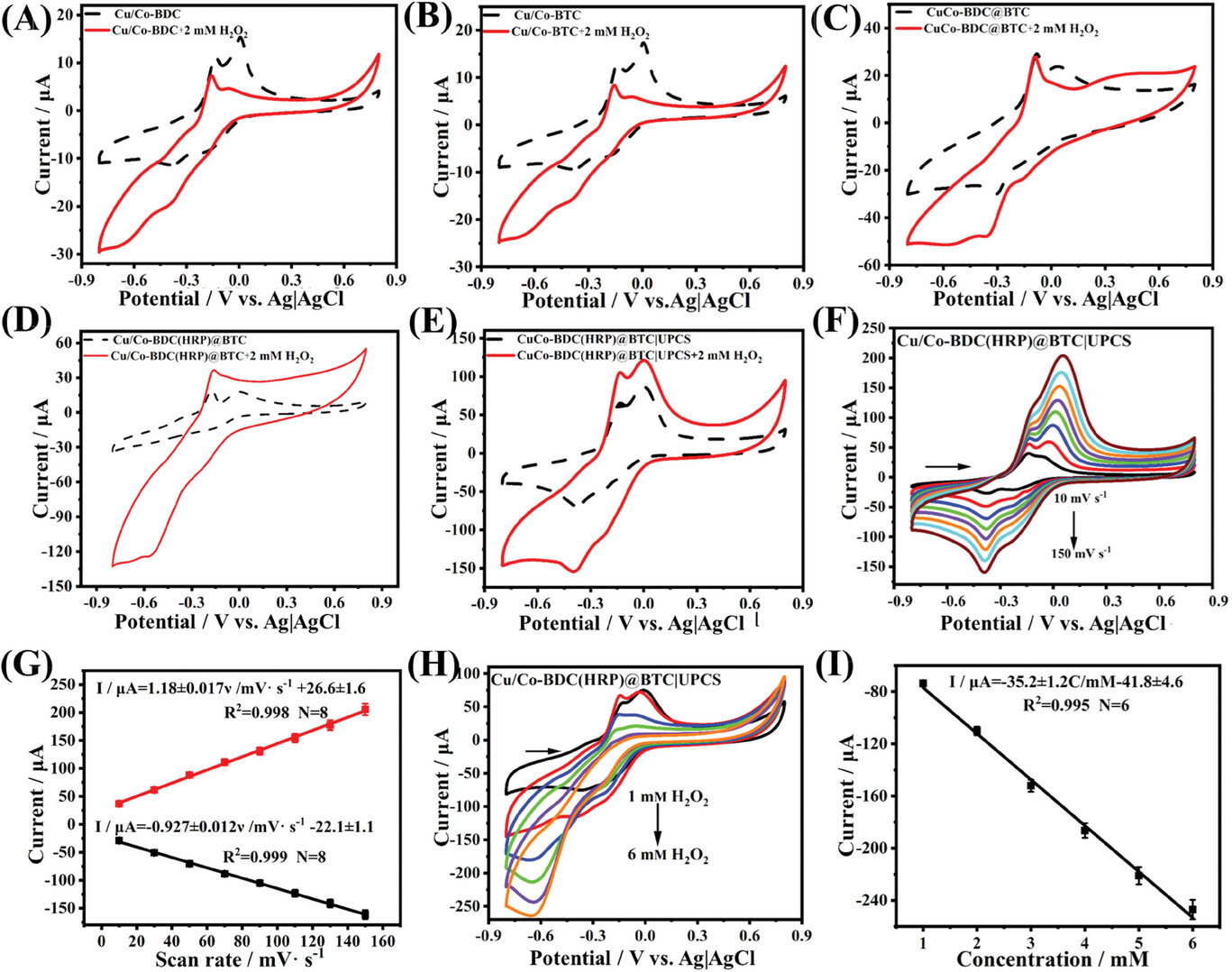
7. 电化学性能测试:
- 通过循环伏安法(CV)和电化学阻抗谱(EIS)评估样品的电化学活性和电子转移特性。
- CV测试结果显示Cu/Co-BDC(HRP)@BTC|UPCS对H2O2的还原峰电流随着H2O2浓度的增加而增加。
8. 实际应用测试:
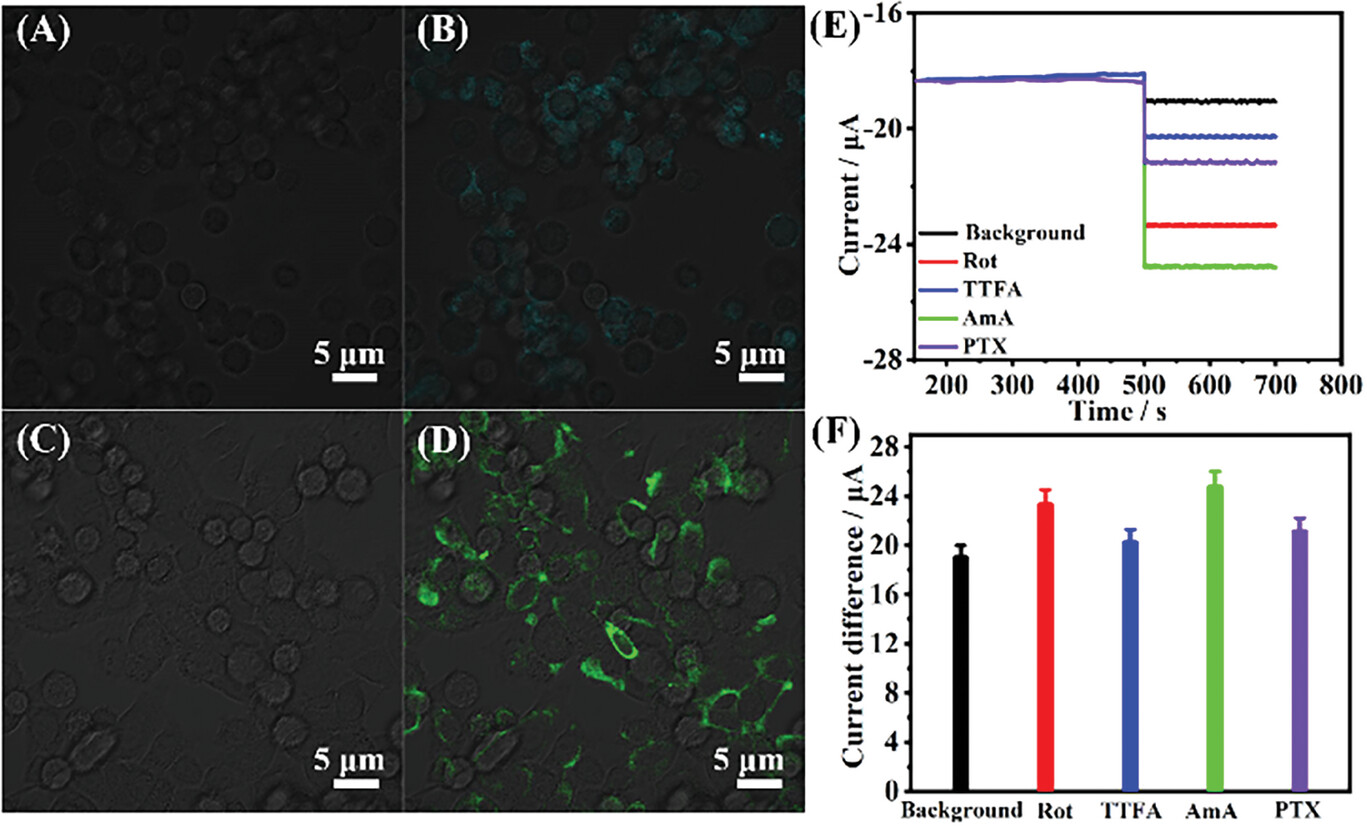
- 通过安培法监测经线粒体复合体抑制剂处理后的HeLa细胞线粒体释放的H2O2。
- 实验结果显示,复合体I和III抑制剂处理后,H2O2释放量显著增加,表明它们是电子泄漏的主要位点。
总结:
本文成功开发了一种基于MOF@MOF的纳米复合物,用于检测活细胞线粒体释放的超氧阴离子经歧化反应产生的H2O2。通过将HRP包覆在MOF平台上,避免了HRP与MOF金属离子的直接接触,从而维持了HRP的结构和活性。此外,通过引入UPCS,显著提高了MOF的电导率。制备的Cu/Co-BDC(HRP)@BTC|UPCS传感平台展现出优异的电化学性能,具有较低的检测限和良好的选择性与稳定性。通过使用线粒体复合体抑制剂处理后,证实了线粒体中的复合体I和III是电子传递链中主要的电子泄漏位点,为氧化应激疾病的预防和治疗提供了新的策略。
展望:
本文的研究成果为氧化应激疾病的早期诊断和治疗提供了重要的科学依据。未来的研究可以在以下几个方面进行补充和深入:
1) 在不同的细胞系和生物体内验证该传感平台的适用性和可靠性。
2) 探索该传感平台在实际临床样本中的应用潜力。
3) 研究该传感平台在长期储存和多次使用后的稳定性和重现性。
4) 开发更加灵敏和选择性的检测方法,以满足临床诊断的更高要求。
An Enzyme-Encapsulated MOF@MOF Nanocomposite for Detecting H2O2 Derived From Superoxide Anion Released by Mitochondria of HeLa Cells
文章作者:Jiaqi Niu, Xiaoxin Jin, Xingqi Wang, Zhenhua Ren, Bingjie Li, Xiaoqiang Liu,*
and Danny K.Y. Wong*
DOI: 10.1002/smtd.202401070
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/smtd.202401070
本文为科研用户原创分享上传用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。





