首页 >
行业动态 > 【MOF荧光探针】氨基官能化金属有机框架作为细胞成像和阿霉素检测的荧光探针
【MOF荧光探针】氨基官能化金属有机框架作为细胞成像和阿霉素检测的荧光探针
摘要:
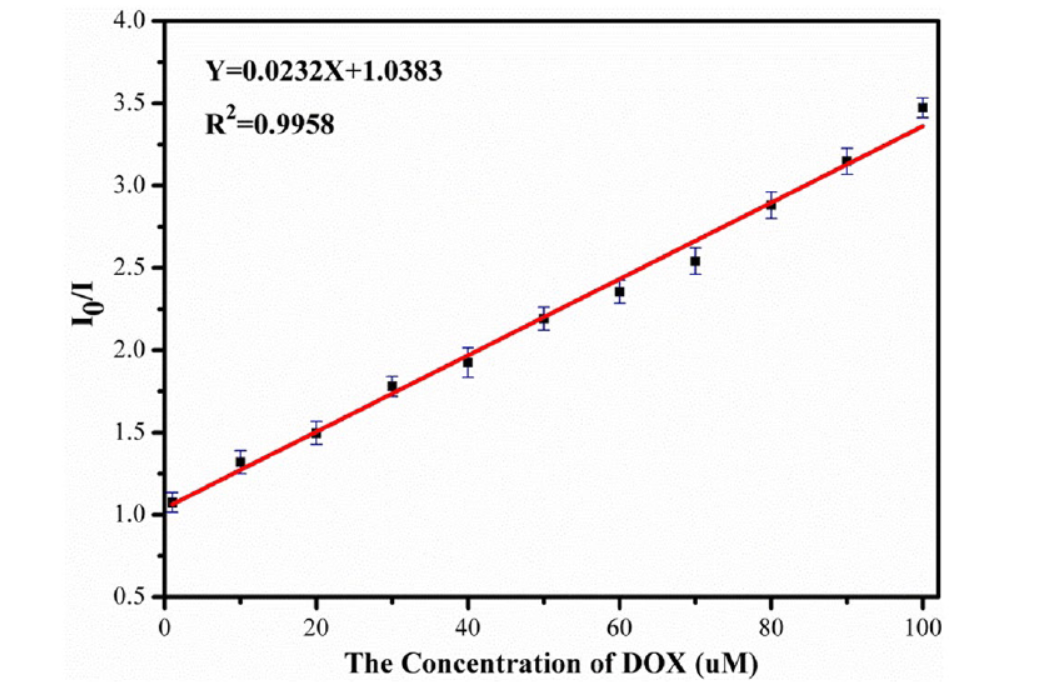
湖北医药学院徐靖、Qiongyao Zhang老师等报道的本篇文章中(J Fluoresc 2024)通过一锅法合成了氨基修饰的铜基金属-有机框架(NH2–Cu–MOF),并将其作为荧光探针用于检测多西他赛(DOX)。合成的NH2–Cu–MOF在1-100 µmol/L的浓度范围内,显示出对DOX的显著荧光识别能力。此外,该材料在多种金属离子和其他抗生素存在的条件下,也能有效地用于DOX的高选择性荧光猝灭识别和定量检测。检测限为2.1654 µmol/L。这些发现强调了NH2–Cu–MOF作为“开-关”荧光探针用于快速检测DOX的潜力。

研究背景:
1)多西他赛(DOX)是一种广泛用于治疗各种癌症的化疗药物,但其广泛使用导致了环境污染问题,对水生态系统构成威胁,并可能促进耐药细菌的发展。因此,开发有效的水体中DOX检测方法对于保护环境和公共健康至关重要。
2)目前,液相色谱与紫外检测、液相色谱-串联质谱、毛细管电泳、离子迁移谱和微生物学方法是抗生素检测的主要分析技术。然而,这些技术通常需要昂贵的仪器,操作复杂且耗时。
3)作者开发了一种基于氨基功能化金属-有机框架(MOFs)的荧光检测方法,该方法具有快速响应、低成本、高灵敏度和操作简便的优点。通过一锅法合成NH2–Cu–MOF,并将其作为荧光探针用于DOX的检测,实现了在复杂水环境中对DOX的高灵敏度和抗干扰检测。
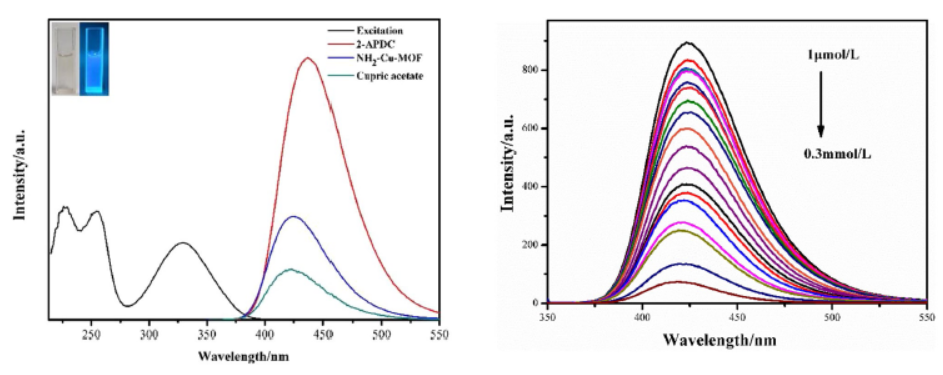
实验部分:
1. NH2–Cu–MOF的合成:
1) 称取0.25 mol的Cu(NO3)2·3H2O和0.45 mmol的2-氨基对苯二甲酸,溶解在混合溶剂中(水/乙醇/N,N-二甲基甲酰胺,体积比1:1:1),总体积为10 mL。
2) 将溶液在70°C下搅拌10分钟,以确保所有固体溶解。
3) 缓慢滴加0.5 mL的三乙胺,边滴加边搅拌,以调节溶液的pH值。
4) 将混合溶液在70°C下继续搅拌24小时,以促进晶体生长。
5) 反应完成后,将混合物冷却至室温,用N,N-二甲基甲酰胺和甲醇洗涤,以去除未反应的前驱体。
6) 将产物在80°C下真空干燥过夜,得到NH2–Cu–MOF的暗绿色粉末。
2. 荧光光度测量:
1) 将合成的NH2–Cu–MOF粉末研磨至通过200目筛,称取6.4 mg。
2) 将粉末分散在40 mL超纯水中,超声处理5分钟,以确保粉末充分分散。
3) 将分散液转移到1 cm光径的石英比色皿中,用于荧光光谱测量。
4) 使用荧光光谱仪(F-7000,Hitachi High-Technologies Corporation)记录荧光光谱,激发和发射缝宽设置为2.5 nm,光电倍增管电压设置为570 V。
3. 荧光滴定实验:
1) 准备一系列不同浓度的DOX标准溶液,浓度范围为1到0.3 mM。
2) 将制备的NH2–Cu–MOF荧光探针分散液与不同浓度的DOX溶液等体积混合。
3) 在室温下孵育2分钟,以允许充分的荧光猝灭反应发生。
4) 使用荧光光谱仪测量混合物在329 nm激发下的荧光强度,记录424 nm处的发射强度。
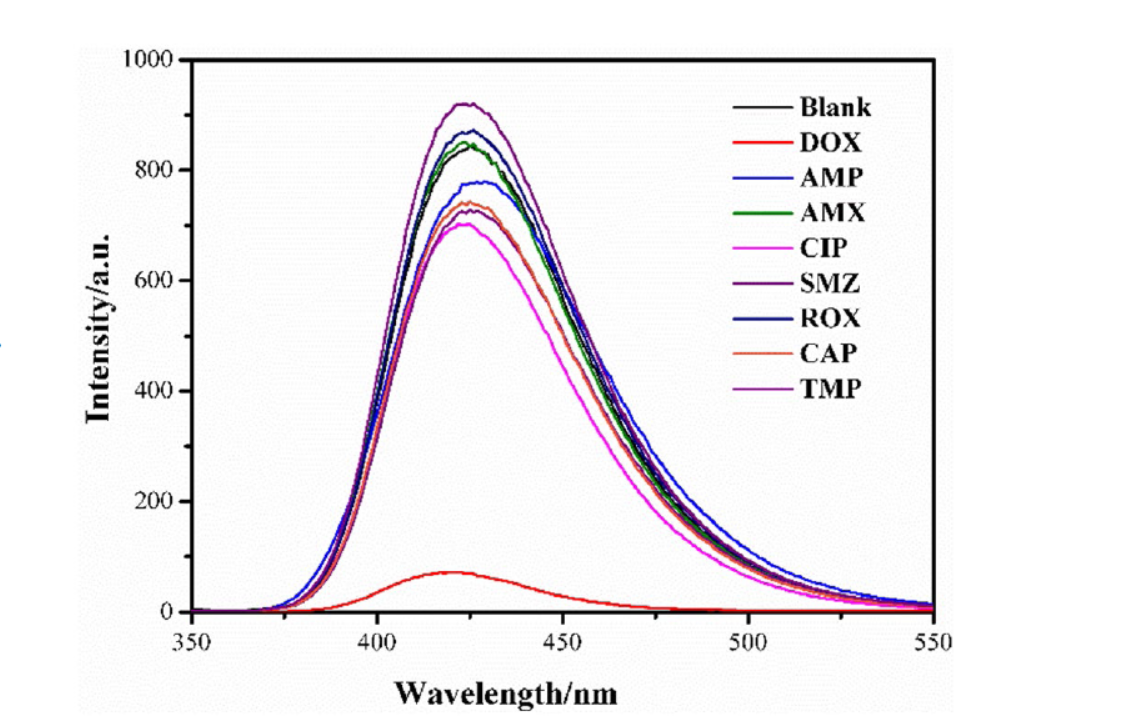
4. 选择性荧光识别DOX:
1) 分别准备含有TMP, ROX, AMP, CAP, SMZ, CIP, AMX等抗生素的溶液,浓度为0.3 mM。
2) 将NH2–Cu–MOF荧光探针分散液与上述抗生素溶液等体积混合。
3) 在室温下孵育2分钟,然后测量荧光强度的变化。
5. 抗干扰能力测试:
1) 准备含有多种金属离子(Na+, Sm3+, Mn2+, Mg2+, Ba2+, Zn2+, Ca2+, Ag+, La3+, Al3+, Co2+, K+, Ni2+, Cr3+)和抗生素(TMP, ROX, AMP, CAP, SMZ, CIP, AMX)的溶液,浓度分别为1 mM和0.6 mM。
2) 将NH2–Cu–MOF荧光探针分散液与上述溶液等体积混合。
3) 在25°C和pH 7.35条件下孵育2分钟,然后测量荧光强度的变化。
6. 荧光探针的可回收性分析:
1) 将NH2–Cu–MOF荧光探针分散液与DOX溶液等体积混合,孵育2分钟。
2) 通过离心分离NH2–Cu–MOF探针,并用超纯水多次洗涤,直至上清液清澈。
3) 将洗涤后的NH2–Cu–MOF探针重新分散在超纯水中,再次进行荧光检测。
4) 重复上述过程5次,以评估探针的可回收性。
7. 细胞毒性评估:
1) 将HepG2细胞接种在96孔板中,每孔5×10^3个细胞,37°C和5% CO2条件下培养24小时。
2) 弃去培养基,每孔加入90 µL新鲜培养基和10 µL不同浓度的NH2–Cu–MOF探针溶液(100-500 µg/mL)。
3) 继续培养24小时后,弃去培养基,每孔加入100 µL新鲜培养基和10 µL CCK-8溶液。
4) 继续培养4小时后,使用酶标仪在450 nm处测量光密度。
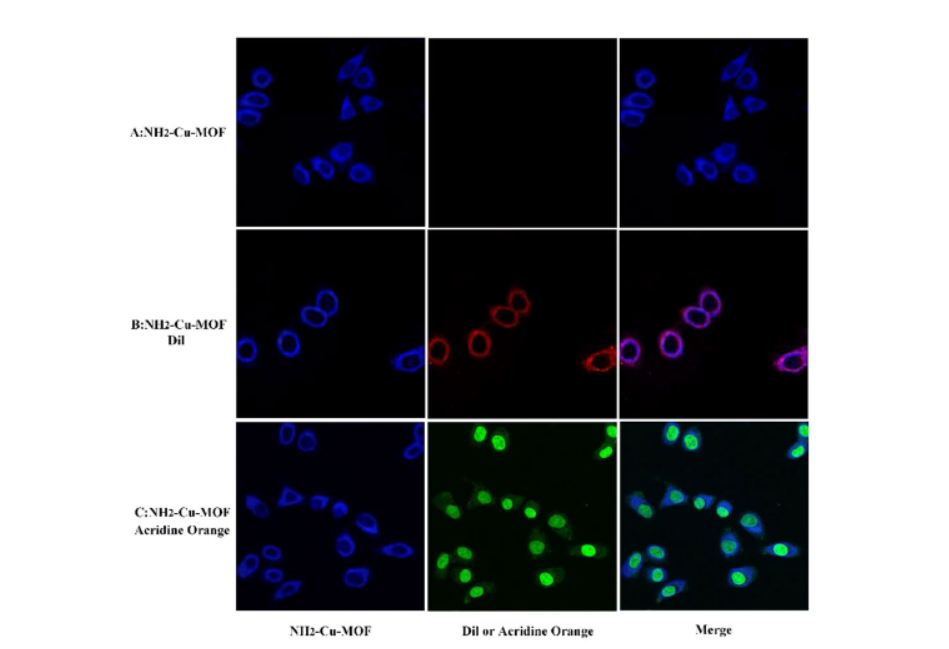
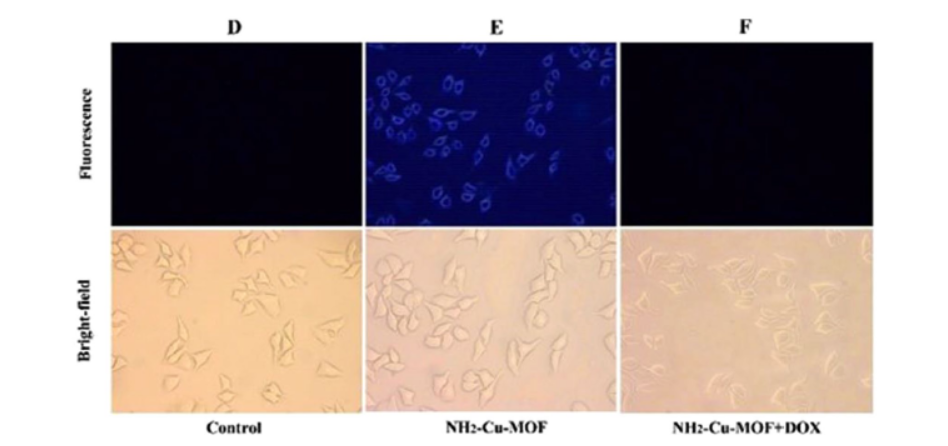
8. 细胞荧光成像:
1) 将HepG2细胞接种在共聚焦培养皿中,每皿1×10^5个细胞,37°C和5% CO2条件下培养24小时。
2) 弃去培养基,每皿加入1 mL NH2–Cu–MOF探针溶液(50 µg/mL),继续培养5小时。
3) 弃去探针溶液,用磷酸盐缓冲液(PBS)洗涤细胞5次,去除未进入细胞的探针。
4) 使用共聚焦激光扫描显微镜(CLSM)观察细胞荧光成像。
分析测试:
1. 样品形态学表征:使用SEM(JSM-7500 F; Japan Electronics Corporation)观察NH2–Cu–MOF的表面形貌,发现其具有均匀的蘑菇云状层状结构,尺寸约为0.5 μm。
2. N2吸附-脱附等温线:在Quantachrome Autosorb-iQ2-MP体积气体吸附分析仪上获得样品的77 K N2吸附-脱附等温线,之前在150 °C下真空脱气过夜。
3. 表面物种分析:使用XPS系统(Empyrean; Thermo Fisher Scientific)进行,使用Al Kα X射线源(1486.6 eV)在200 W下进行概览扫描,在300 W下进行核心级光谱分析。
4. 粉末X射线衍射(PXRD)结果:
5. 衰减全反射傅里叶变换红外光谱(ATR-FTIR):在Bruker V70仪器上进行。
6. 静态水接触角(WCAs)测定:使用OCAH200接触角测量仪(DataPhysics, Germany)记录
7. 紫外-可见(UV-vis)光谱记录:在Shimadzu UV-2501 PC分光光度计上以吸光度模式记录。
8. 比表面积和孔隙结构分析:NH2–Cu–MOF的比表面积为1230 m²/g,孔径分布中心在1.2 nm。
9. XPS分析:NH2–Cu–MOF的XPS谱图显示了Cu 2p3/2的峰位于934.8 eV,N 1s的峰位于399.5 eV。
10. FTIR分析:NH2–Cu–MOF的FTIR谱图在1629 cm−1和1396 cm−1处显示出特征吸收峰,归因于2-氨基对苯二甲酸的羧酸基团。
11. WCA测定:NH2–Cu–MOF的水接触角为72°,表明其具有较好的亲水性。
12. UV-vis光谱分析:NH2–Cu–MOF在329 nm处显示出最大吸收峰。
13. 水稳定性测试:NH2–Cu–MOF在水中浸泡48小时后,PXRD结果显示其晶体结构保持不变,表明其具有良好的水稳定性。
14. 固定化脂肪酶性能评估:NH2–Cu–MOF作为固定化载体,脂肪酶的活性恢复率达到95%,表明其具有良好的生物相容性。
15. 脂肪酶重复使用性评估:固定化脂肪酶在连续5次使用后,活性保持在90%以上,显示出优异的重复使用性。
总结:
本研究成功构建了一种新型的NH2–Cu–MOF荧光探针,具有优异的水稳定性,可高度灵敏且抗干扰地检测复杂水环境中的微量DOX。在0-100 µmol/L的浓度范围内,DOX可被定量检测,且不受其他类别抗生素和金属离子的干扰。NH2–Cu–MOF探针表现出低毒性、良好的生物相容性和细胞膜透过性,可用作细胞内外DOX的选择性检测和荧光成像研究,具有生物活性分析的潜在应用。
展望:
本文的科研成果为DOX的检测提供了一种新方法,具有重要的环境和健康意义。未来的研究可以进一步探索NH2–Cu–MOF在其他生物标志物检测中的应用,以及其在实际水样检测中的性能。此外,可以研究NH2–Cu–MOF的长期稳定性和重复使用性,以及其在不同环境条件下的检测效果,以期实现更广泛的应用。
Amino-Functionalized Metal–Organic Framework as Fluorescence Probe for Cell Imaging and Doxorubicin Detection
文章作者:Min Hu · Lun Luo · Jing Xu · Qiongyao Zhang
DOI:10.1007/s10895-024-03875-7
文章链接:https://link.springer.com/article/10.1007/s10895-024-03875-7
本文为科研用户原创分享上传用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。





