首页 >
行业动态 > 超声可编程氢键有机框架:无创深部脑调控的新型药物递送平台
超声可编程氢键有机框架:无创深部脑调控的新型药物递送平台
摘要:
美国得克萨斯大学奥斯汀分校Huiliang Wang和圣安东尼奥分校陈邦林老师等报道的本篇文章(Nature 638, 401–410 (2025))中提出了一种基于氢键有机框架(HOFs)的超声可编程药物递送系统(UltraHOF),实现了非侵入性、时空精准的深部组织分子调控。该系统通过设计有机构建单元的氢键密度与芳香环数量,构建了具有可调超声响应阈值的多孔HOFs,负载化学遗传药物氯氮平N-氧化物(CNO)后,在聚焦超声(FUS)触发下可实现秒级药物释放,成功调控小鼠和大鼠腹侧被盖区(VTA)神经回路,且穿透深度达9 mm,为深部脑疾病的精准治疗提供了革命性工具。
研究背景:
1. 行业问题
1)深部组织精准调控面临技术瓶颈:光遗传学等技术受光子穿透限制,无法作用于深层脑区;传统化学遗传学存在脱靶效应和时间分辨率低的问题,依赖药物药代动力学,难以实现即时调控。
2)超声触发药物递送系统存在缺陷:现有聚合物、脂质体等载体需高超声功率激活,响应时间长达数小时,且缺乏分子层面的理论模型指导材料设计,无法实现可编程调控。
2)药物递送系统需兼顾多重性能:理想平台需具备高载药量、低提前释放率、生物相容性及超声响应精准性,现有材料难以同时满足这些要求。
2. 研究现状
1)多孔框架材料(如MOFs、COFs)已用于药物递送,但强配位键或共价键导致其机械响应性差,无法通过超声高效激活。
2)HOFs凭借氢键和π-π堆积形成的柔性框架,具备机械响应潜力,但尚未被开发为超声可编程的药物递送平台,且缺乏结构-超声敏感性的构效关系研究。
3)超声触发的药物释放系统多依赖共价键断裂或相转变,存在响应阈值不可调、生物安全性不足等问题,难以应用于脑科学研究与临床转化。
3. 本文创新
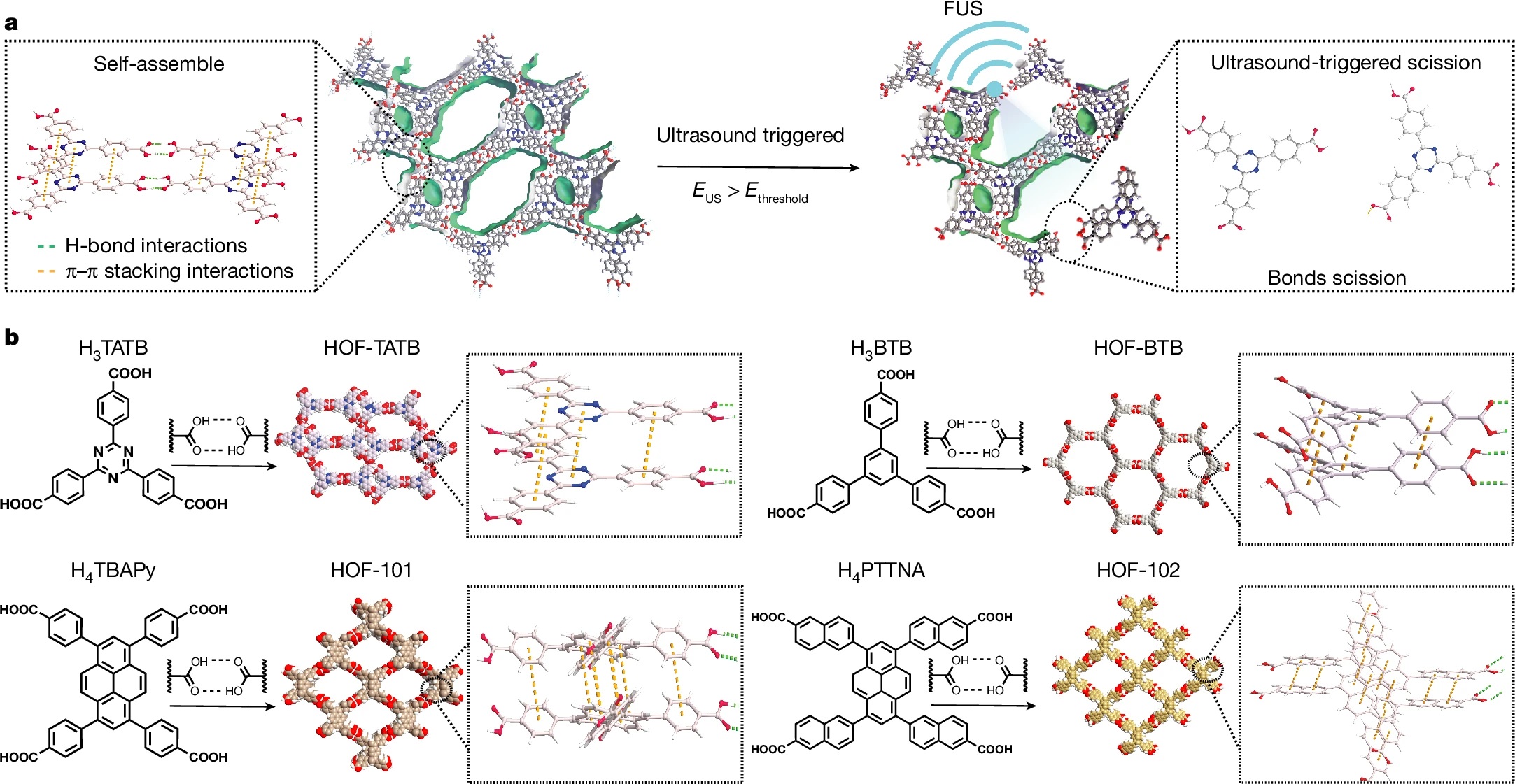
1)首次将HOFs开发为超声可编程药物递送平台,通过调控有机构建单元(OMBUs)的氢键数量和芳香环结构,实现超声响应阈值的精准可调(0.07-7.33 MPa)。
2)建立了氢键作用、π-π堆积能与超声响应效率的理论模型,为机械响应材料的分子设计提供定量指导,实现按需触发药物释放。
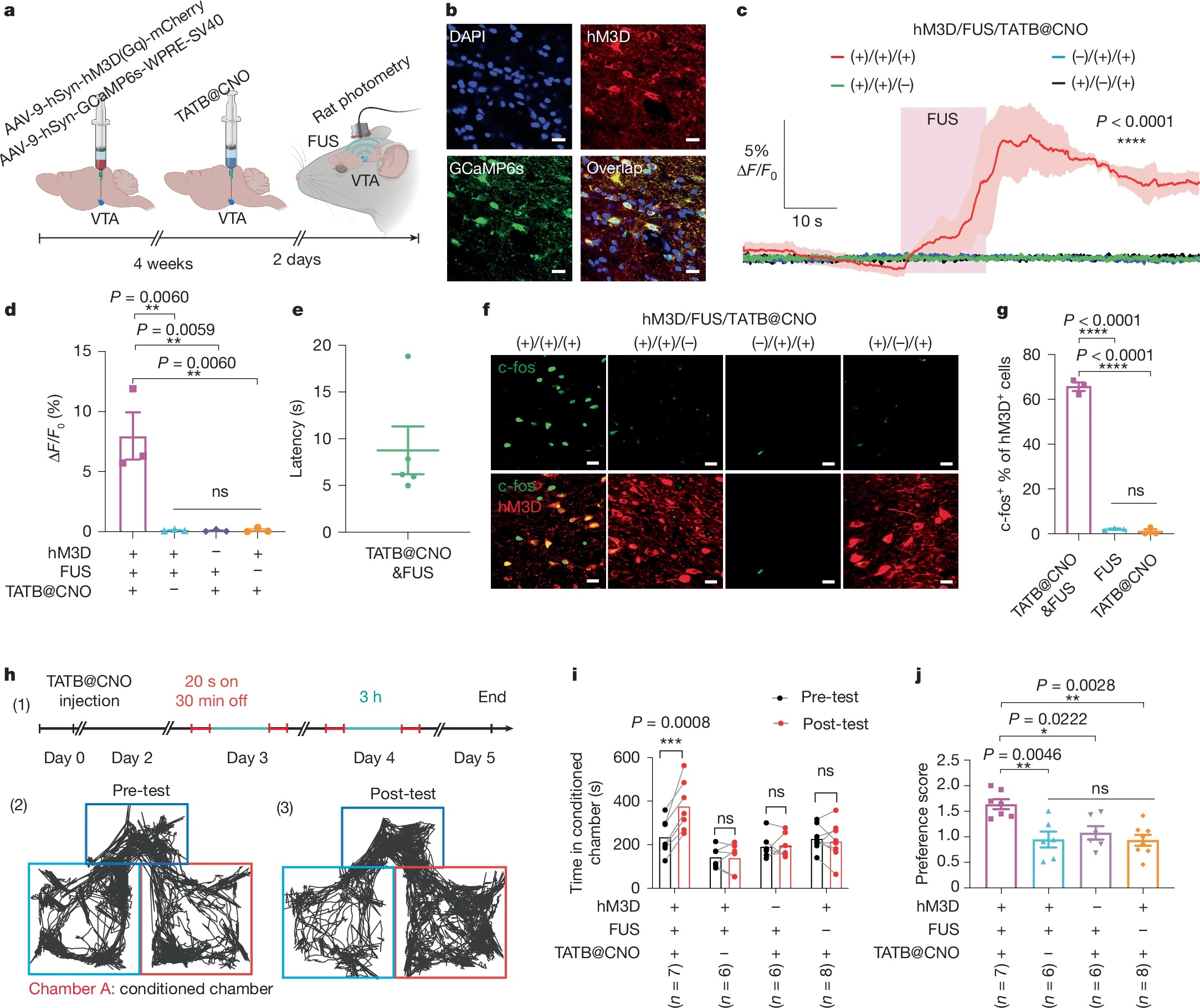
3)实现了深部脑区的无创精准调控:在小鼠和大鼠VTA区域实现秒级神经激活( latency 3.5-8.8 s),持续激活超60 s,且生物相容性优异,无血脑屏障损伤或炎症反应。
实验和分析:
1. 材料合成
通过沉淀法合成四种HOFs纳米晶体(HOF-TATB、HOF-BTB、HOF-101、HOF-102),选用不同氢键密度和芳香环数量的有机构建单元。以HOF-TATB为例,将H₃TATB溶解于DMF,加入蒸馏水搅拌10 min后离心洗涤,产率约30%,粒径为250-600 nm。药物负载通过将HOFs与CNO、多巴胺等药物在40°C振荡2 h,离心去除未负载药物,载药量最高达29.8±1.3%。
2. 表征结果
1)结构表征:HOF-TATB通过微晶体电子衍射确定为双互穿3D氢键网络,空间群P2/c,孔道尺寸12.2×23.9 Å,溶剂可及孔容50.3%;PXRD验证四种HOFs均具有高结晶度,热稳定性优异,100°C下无明显分解。
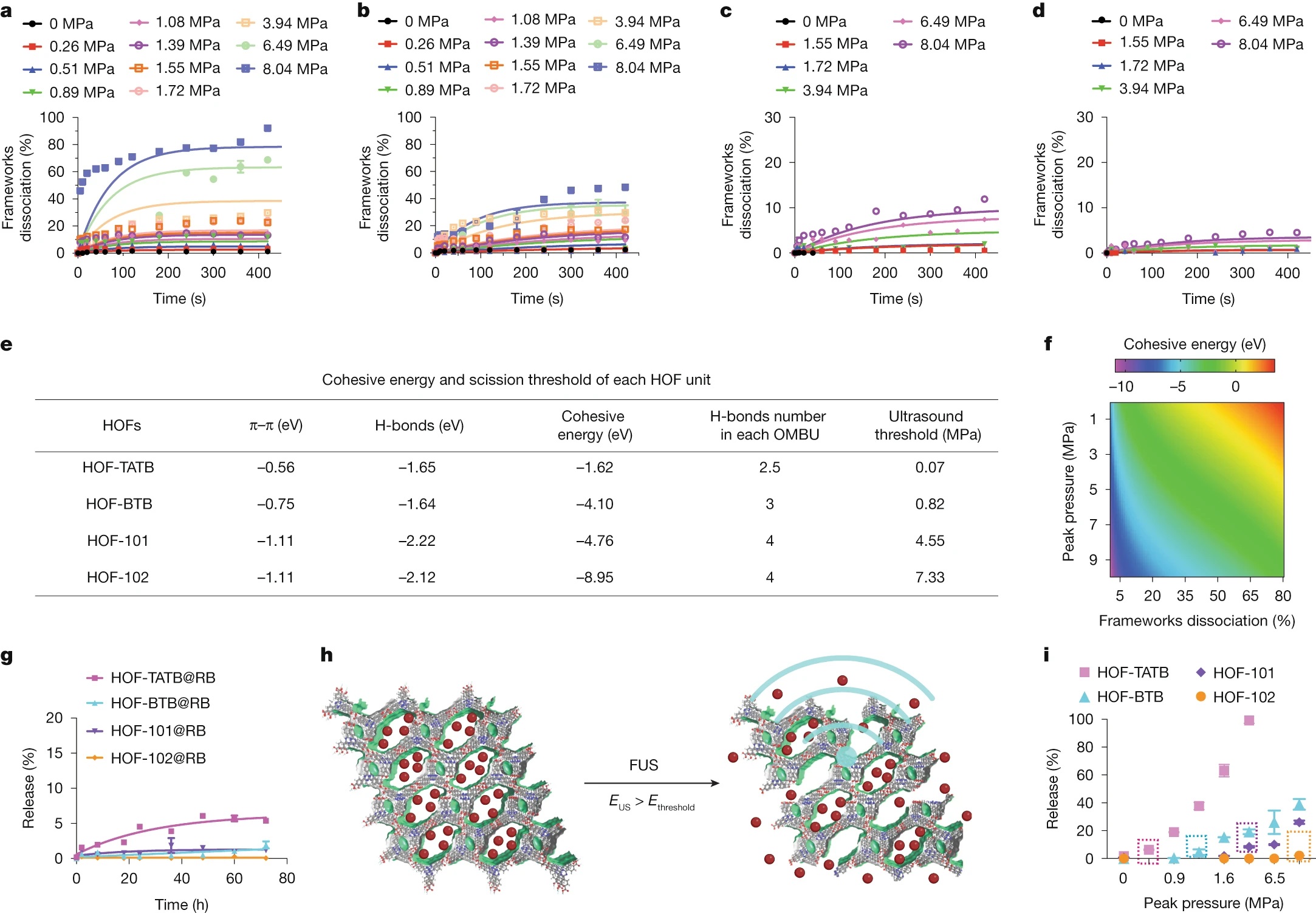
2)超声响应性能:DFT计算表明HOFs的内聚能与超声阈值正相关(HOF-TATB最低,0.07 MPa;HOF-102最高,7.33 MPa),超声触发后框架解离率随压力升高而增加,且无热分解干扰。
3)生物相容性:HOF-TATB在10%胎牛血清中稳定性良好,溶血率低,HEK-293T细胞存活率在高浓度下仍保持80%以上;体内实验未观察到小胶质细胞激活、神经元凋亡及血脑屏障损伤。
3. 应用性能测试
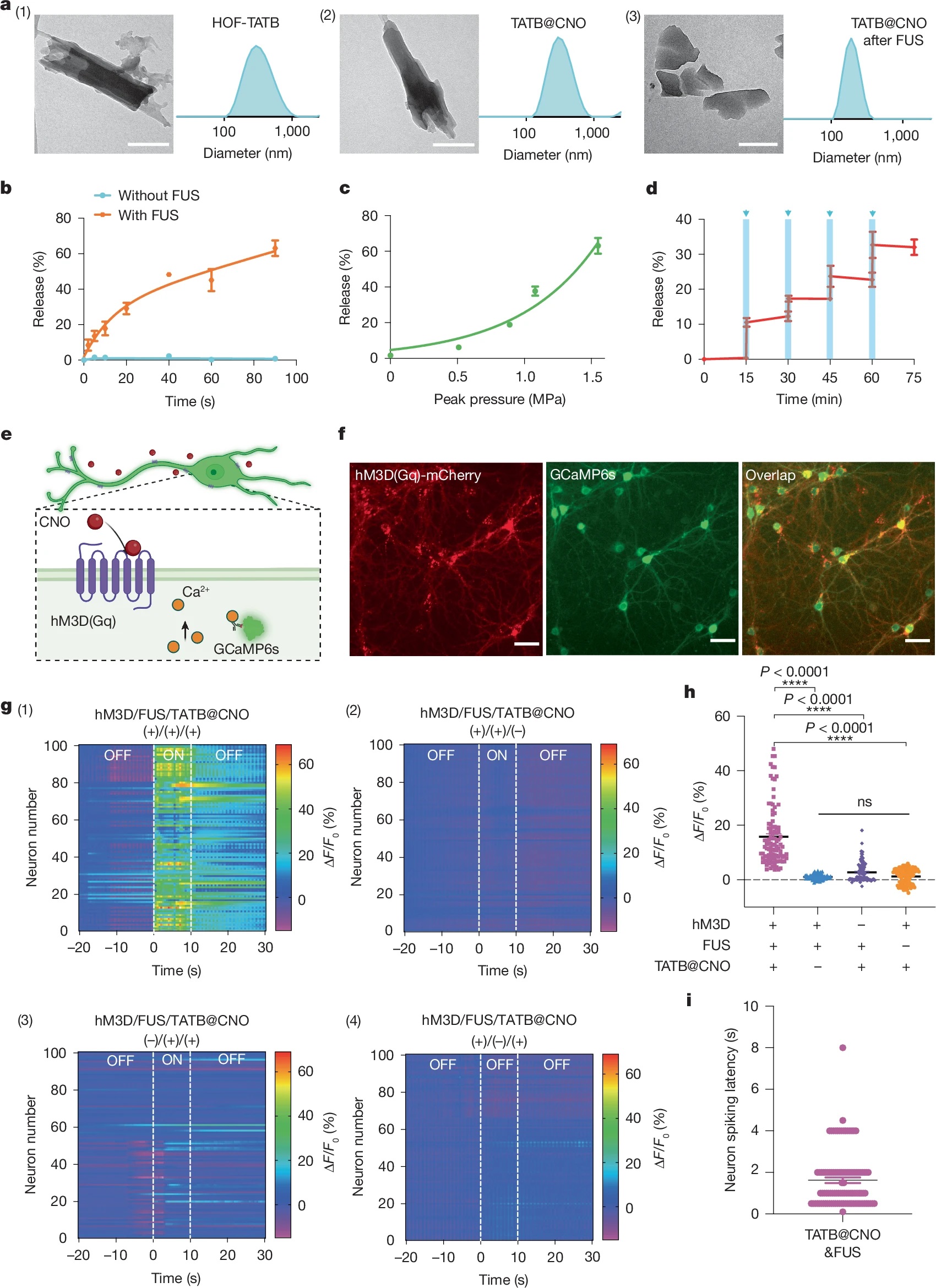
1)体外药物释放:HOF-TATB@CNO在超声(1.5 MHz,0.51 MPa)触发下60 s内药物释放率达40%,无超声时3天提前释放率仅5.5%,且可通过重复超声脉冲实现多次药物释放。
2)细胞水平调控:在表达hM3D(Gq)受体的原代皮质神经元中,超声触发CNO释放后,90%以上神经元在1.6 s内激活,钙信号持续超60 s,对照组无明显激活。
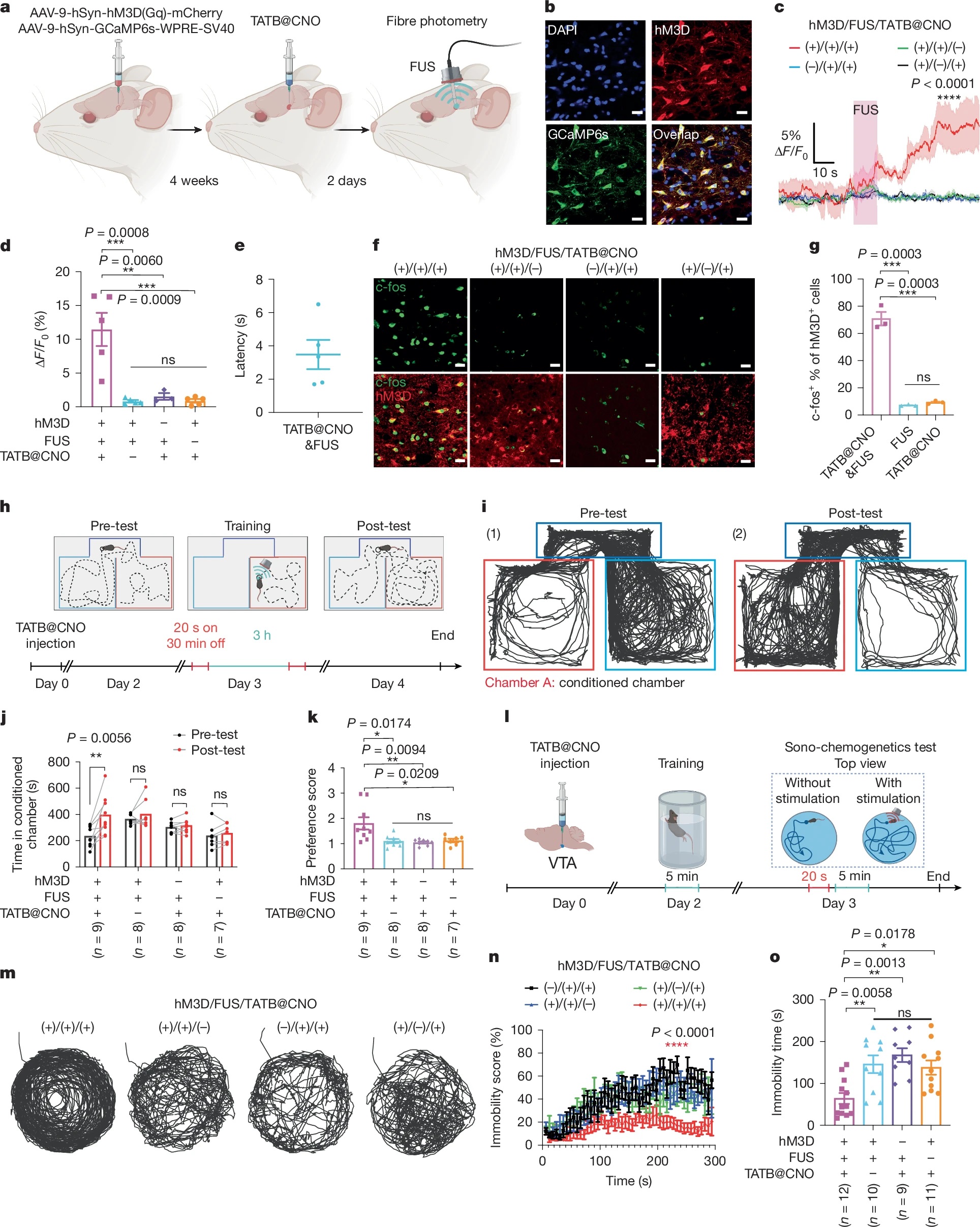
3)体内神经调控:在小鼠VTA区域,超声触发后3.5 s内即可检测到神经元钙信号升高,持续激活120 s以上;5天后仍可通过重复超声实现神经激活,c-fos染色证实仅靶向区域神经元被激活。
4)行为学调控:超声触发VTA神经激活后,小鼠在条件性位置偏好实验中对刺激区域的停留时间翻倍,强迫游泳实验中不动时间显著减少,表现出抗抑郁样行为;大鼠实验同样验证了该系统的深部脑调控能力。
4. 机理分析
1)超声响应机制:超声产生的机械应力为氢键和π-π堆积键断裂提供驱动力,当超声能量超过HOFs的解离阈值时,框架快速解离释放药物,内聚能由氢键数量和芳香环相互作用共同决定。
2)理论模型:建立了“超声压力-ln(k)-内聚能”三变量线性模型,可预测特定解离率所需的材料内聚能和超声参数,为HOFs的精准设计提供指导。
3)神经调控机制:超声触发CNO快速释放,与神经元表面hM3D(Gq)受体结合,激活下游信号通路导致钙内流,实现神经回路的即时激活,且HOFs的多孔结构保证药物高效扩散至靶点。
总结:
1. 成功开发了超声可编程HOFs递送系统,通过调控分子间弱相互作用实现超声响应阈值可调(0.07-7.33 MPa),兼具高载药量(最高29.8%)、低提前释放率(最低0.1%)和优异生物相容性。
2. 实现了深部脑区的无创精准调控,在小鼠和大鼠VTA区域实现秒级神经激活( latency 3.5-8.8 s),持续激活超60 s,可有效调控动物情绪相关行为,为化学遗传学提供了高时空分辨率的工具。
3. 建立了机械响应材料的结构-性能理论模型,为超声可编程递送系统的分子设计提供定量指导,拓展了HOFs在生物医学领域的应用,有望用于神经疾病、癌症等深部组织疾病的精准治疗。
H-bonded organic frameworks as ultrasound-programmable delivery platform
文章作者:Wenliang Wang, Yanshu Shi, Wenrui Chai, Kai Wing Kevin Tang, Ilya Pyatnitskiy, Yi Xie, Xiangping Liu, Weilong He, Jinmo Jeong, Ju-Chun Hsieh, Anakaren Romero Lozano, Brinkley Artman, Xi Shi, Nicole Hoefer, Binita Shrestha, Noah B. Stern, Wei Zhou, David W. McComb, Tyrone Porter, Graeme Henkelman, Banglin Chen, Huiliang Wang
DOI:10.1038/s41586-024-08401-0
文章链接:https://doi.org/10.1038/s41586-024-08401-0
本文为科研用户原创分享用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。




