首页 >
行业动态 > 【介孔HOF】基于小分子生物相容性分子的高度有序大孔氢键有机框架材料
【介孔HOF】基于小分子生物相容性分子的高度有序大孔氢键有机框架材料
摘要:
中国科学院福建物质结构研究所刘天赋老师等报道的本篇文章(Nat Commun (2025))中报道了一种模板法合成策略,成功制备出基于小分子生物相容性分子的高度有序大孔氢键有机框架(OM-HOFs)。通过选择具有多个氢键位点和广泛π共轭的小分子生物相容性构筑单元,使其在模板存在下自组装形成目标结构,且模板去除后仍能保持结构完整性,实现了从致密堆积的氢键晶体材料向大孔结构的转化。该OM-HOFs具有单晶特性、高生理稳定性和增强的传质效率,极大地拓展了HOF材料库至小型、廉价、低毒且临床适用的分子体系,在酶固定化等生物相关应用中展现出巨大潜力。研究中成功将胰蛋白酶负载于大孔HOFs中,该复合材料可作为有效的细胞支架,促进外周血单核细胞向成纤维细胞分化,为生物医学应用提供了新的思路。
研究背景:
1.行业问题
1) 分子基多孔材料的孔径调控是应用关键,传统分子设计难以实现大孔(尤其是介孔或大孔)结构,且有机合成难度大、成本高,还可能存在生物毒性和生物应用稳定性不足的问题。
2) 模板法虽为大孔材料合成提供了有效途径,但基于弱非共价相互作用(如氢键)的分子组装体系中,模板易破坏自组装过程,且组装结构在模板去除后缺乏稳定性,难以形成稳定大孔结构。
2.研究现状
1) 现有大孔氢键有机框架(HOFs)的制备多依赖晶体形貌调控形成空隙(如调节溶剂挥发速率),但缺乏普适性策略用于制备高密度、均匀孔径的大孔HOFs。
2) HOFs在生物医学领域的应用受限于构筑单元的生物相容性和孔径大小,现有材料难以同时满足生物安全性、结构稳定性和功能适配性的要求。
3.本文创新
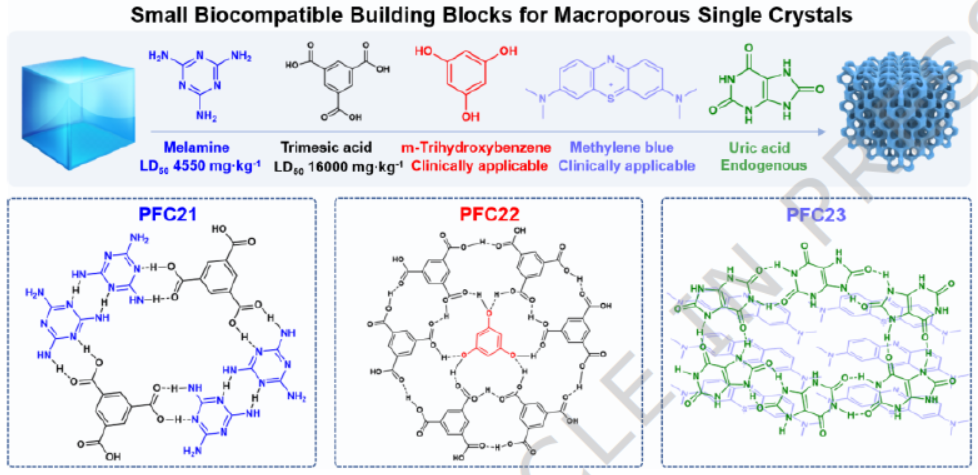
1) 提出选择具有多个氢键供体/受体位点和广泛π共轭的小分子生物相容性构筑单元,利用多重氢键和π-π相互作用引导自组装,确保模板存在下形成目标结构,且模板去除后结构稳定。
2) 首次通过模板法成功合成单晶态高度有序大孔HOFs,孔径可在100-200 nm之间调控,突破了传统HOFs孔径设计的局限。
3) 该策略拓展了HOF材料的构筑单元范围,实现了低毒、无金属、生物相容性优良的大孔HOFs制备,为其在酶固定化、细胞支架等生物医学领域的应用奠定基础。
实验和分析:
1.材料合成
1) 模板制备:通过乳液聚合合成直径为100、150、200 nm的单分散聚苯乙烯(PS)微球,真空过滤得到有序PS模板。
2) OM-HOFs合成:以三聚氰胺(MA)与均苯三甲酸(TMA)、间苯三酚(THB)与TMA、亚甲基蓝(MB)与尿酸(UA)为生物相容性构筑单元,将一种单体溶液浸渍PS模板并干燥后,与另一种单体溶液混合,自组装24小时后,用二氯甲烷去除PS模板,离心洗涤得到OM-PFC21、OM-PFC22、OM-PFC23。
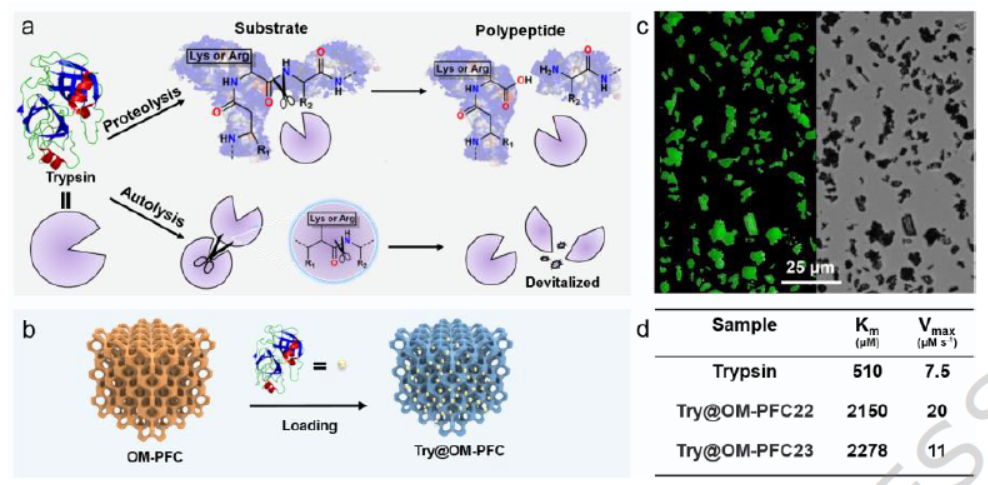
3) 酶固定化与凝胶复合材料制备:将OM-HOFs分散于胰蛋白酶(Trypsin)的PBS溶液中,振荡吸附24小时后离心洗涤,得到Try@OM-PFC;将Try@OM-PFC与羧甲基纤维素(CMC)-聚乙二醇(PEG)复合凝胶混合,冷却后形成Try@OM-PFC/GEL细胞支架。
2.结构表征
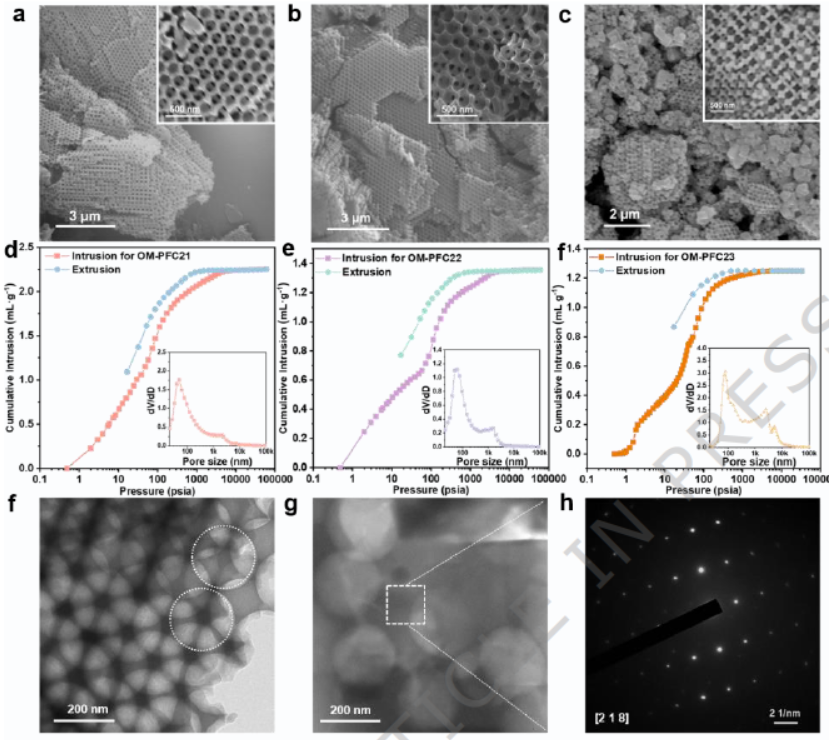
1) PXRD与SAED:OM-PFC系列材料的PXRD图谱与对应氢键共晶体一致,选区电子衍射(SAED)显示清晰晶格条纹,证实其单晶特性。
2) SEM与TEM:材料呈现高度有序的球形大孔结构,孔径约200 nm,孔间通过30-60 nm通道相连,TEM进一步验证了大孔结构的均匀性。
3) 孔隙与稳定性分析:氮气吸附-脱附曲线为IV型等温线,汞侵入孔隙率法证实大孔体积和孔径分布;材料在PBS缓冲液和人工汗液中浸泡一周后,结构和形貌保持完整,质量 retention率高,显示出优异的生理稳定性。
3.应用性能测试
1) 胰蛋白酶固定化:OM-PFC21和OM-PFC22的胰蛋白酶负载量分别达1.21 mg/mg和1.47 mg/mg,远高于同类吸附材料;负载后酶仍遵循米氏动力学,Try@OM-PFC21的Vmax(20 μM·s⁻¹)是游离酶(7.5 μM·s⁻¹)的2.5倍。
2) 稳定性与可重复使用性:37℃储存5天后,Try@OM-PFC仍保持85%的初始活性,而游离酶仅保留26%;循环使用4次后,活性仍维持80%,无明显酶泄漏。
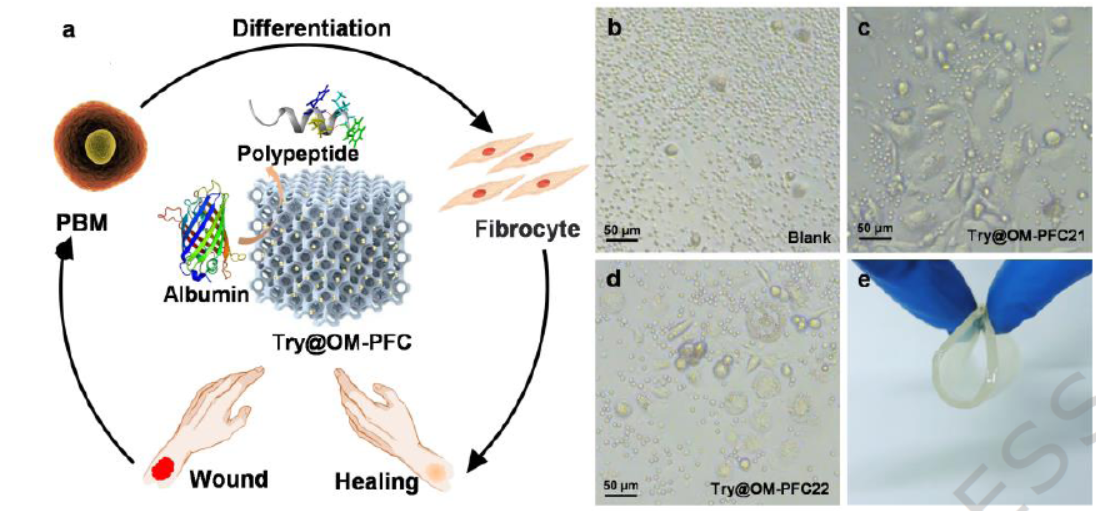
3) 细胞分化与伤口敷料应用:Try@OM-PFC可促进外周血单核细胞(PBMC)向成纤维细胞分化,形成的Try@OM-PFC/GEL支架具有柔软粘弹性、透明性和保湿性,能水解底物BAPNA,保留酶活性,可作为伤口敷料保护创面并促进愈合。
4.机理分析
1) 自组装机理:构筑单元间的多重氢键和π-π堆积作用确保了模板存在下的有序自组装,且模板去除后结构不坍塌,形成稳定大孔结构。
2) 酶固定化与稳定机理:OM-HOFs的大孔结构提供充足负载空间,且与胰蛋白酶之间存在氢键相互作用,减少酶的自聚集和自溶,提升其稳定性和催化活性。
3) 细胞分化机理:Try@OM-PFC水解血清中的白蛋白生成多肽片段,为细胞提供营养,促进PBMC向成纤维细胞分化,且避免了游离酶对健康组织的损伤。
总结:
1. 开发了模板法合成策略,以小分子生物相容性分子为构筑单元,成功制备出单晶态高度有序大孔HOFs(OM-PFC系列),孔径可调控,结构稳定且生物相容性优良。
2. 该OM-HOFs作为酶固定化载体,表现出高负载量、高催化活性、优异的储存稳定性和可重复使用性,且负载胰蛋白酶后可促进成纤维细胞分化。
3. 基于Try@OM-PFC制备的凝胶支架兼具生物降解性、舒适性和透明性,为伤口愈合等生物医学应用提供了新型材料平台,拓展了HOF材料的应用范围。
Highly ordered macroporous hydrogen-bonded organic frameworks based on small biocompatible molecules
文章作者:Qiu-Xia Li, Wan-Zhen Cai, Xiao-Liang Ye, Yi Zeng, A. R. Mahammed Shaheer, Zai-Sheng Ye, Tian-Fu Liu
DOI:10.1038/s41467-025-67123-7
文章链接:https://www.nature.com/articles/s41467-025-67123-7
本文为科研用户原创分享用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。



