首页 >
行业动态 > 【NU-1000】耐酸介孔金属有机框架用于口服胰岛素递送:蛋白质的包封、保护与释放
【NU-1000】耐酸介孔金属有机框架用于口服胰岛素递送:蛋白质的包封、保护与释放
摘要:
全球数百万人群受糖尿病困扰且患者数量逐年增加,虽已有多种治疗1型和2型糖尿病的方法,但胰岛素抵抗患者仍需依赖胰岛素注射。本研究将胰岛素固定在结晶介孔金属有机框架NU-1000中,30分钟内实现约40 wt%的高负载量。该耐酸MOF胶囊能有效保护胰岛素免受胃酸和胃蛋白酶降解,且在模拟生理条件下可释放包封的胰岛素。
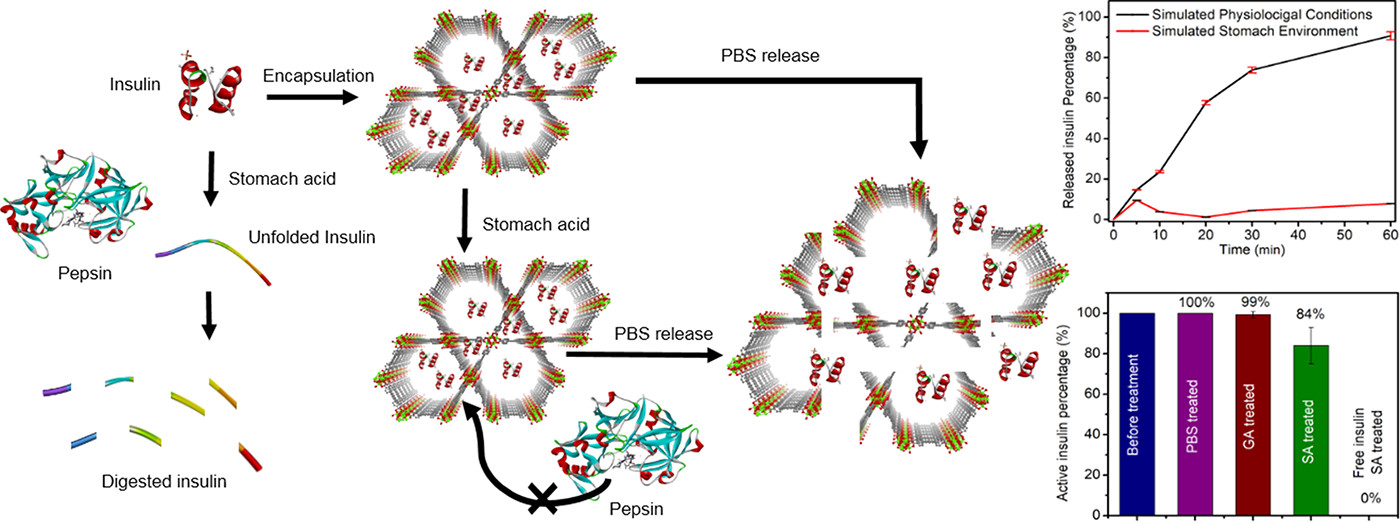
研究背景:
1.行业问题和研究现状:口服胰岛素递送面临胰岛素在胃肠道易被胃酸和蛋白酶降解的问题,现有藻酸盐微球、纳米颗粒等载体负载量仅5-30 wt%,需过量载体或添加吸附增强剂,增加患者负担。
2.本文创新:选用锆基介孔MOF NU-1000,其耐酸(pH低至1)、孔径和表面电荷可调,且在血液磷酸盐中可降解以释放胰岛素,满足高负载、保护和控释需求。
实验部分:
1.NU-1000制备与胰岛素包封:按文献方法合成并活化NU-1000,将3mg 2μm长的MOF晶体在室温下浸泡于4×10⁻⁴g/L胰岛素水溶液(pH4)30分钟,过滤洗涤得insulin@NU-1000;用AlexaFluor-647标记胰岛素,监测负载过程。结果:30分钟达最高负载,NU-1000负载量40 wt%。
2.胰岛素释放实验:将insulin@NU-1000分别置于pH1.29模拟胃酸和pH7.0模拟生理液1小时,UV-vis监测释放量。结果:胃酸中1小时仅释放10%胰岛素,生理液中1小时释放91%;NU-1000在胃酸中稳定1小时以上,生理液中1小时释放10% linker。
3.胰岛素活性检测:用ELISA试剂盒检测不同条件下释放胰岛素的活性。结果:游离胰岛素在胃酸中失活,insulin@NU-1000在PBS中释放的胰岛素活性完好,经胃酸/胃液处理后释放的胰岛素活性分别保留99%、84%。
分析测试:
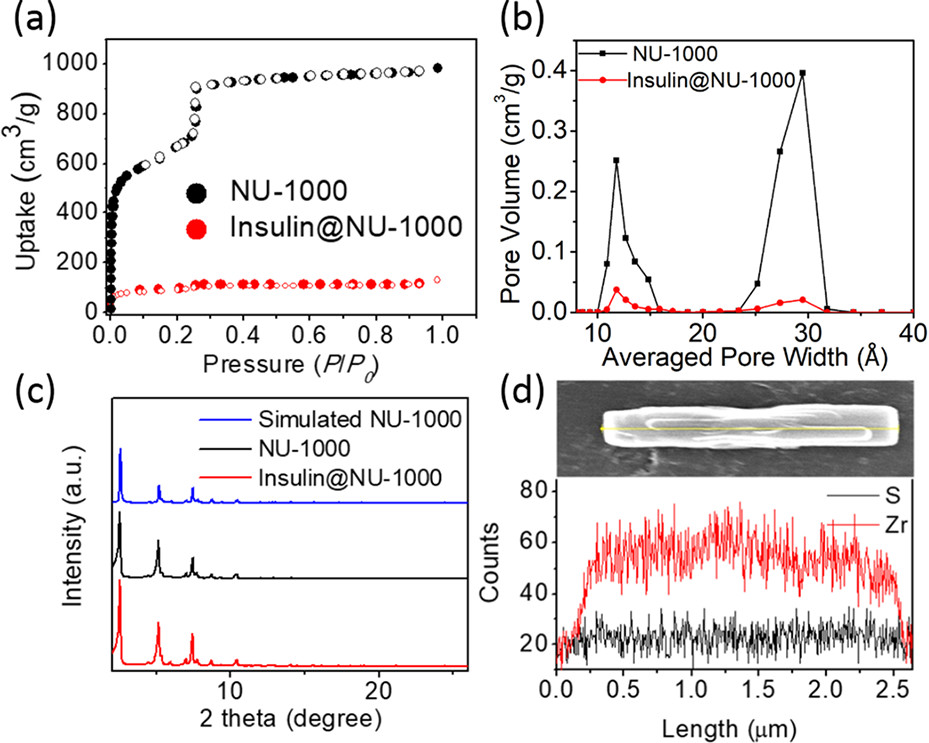
1.ICP-OES:测insulin@NU-1000中S(胰岛素二硫键)与Zr(NU-1000)比例,得胰岛素与NU-1000摩尔比1:7,质量比5808:15191,负载量约40 wt%。
2.N₂吸附-脱附与DFT分析:NU-1000经包封后N₂吸附量下降,比表面积降低;DFT孔径分布显示介孔和微孔体积减少,表明胰岛素占据两种孔道。
3.PXRD与SEM:PXRD证实包封后NU-1000结晶度保留;SEM-EDX显示Zr和S(胰岛素)在晶体中均匀分布,晶体尺寸无明显变化。
4.TGA:insulin@NU-1000热重损失与ICP-OES测得的40 wt%负载量一致。
5.CLSM:观察到AlexaFluor-647标记的胰岛素在10μm NU-1000晶体中均匀分布,随时间负载量增加。
6.Zeta电位与DLS:测不同pH下胰岛素、NU-1000及复合物的Zeta电位;DLS得NU-1000晶体尺寸分布,助力分析相互作用与分散性。
总结:
1.主要研究结果:实现NU-1000对胰岛素的高负载、有效保护及生理条件下的控释,且释放的胰岛素活性高。
2.创新突破:NU-1000负载量远超现有载体,耐酸且可在生理环境降解,无需添加有害增强剂。
3.潜在意义:为口服胰岛素递送提供可行载体,有望替代注射,减轻患者痛苦。
Acid-Resistant Mesoporous Metal–Organic Framework toward Oral Insulin Delivery: Protein Encapsulation, Protection, and Release
文章作者:Yijing Chen, Peng Li, Justin A. Modica, Riki J. Drout, Omar K. Farha
DOI:10.1021/jacs.8b02089
文章链接:https://pubs.acs.org/doi/10.1021/jacs.8b02089
本文为科研用户原创分享用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。

