首页 >
行业动态 > 【铪MOF材料】用于X射线刺激癌症治疗的纳米级混合配体金属有机框架
【铪MOF材料】用于X射线刺激癌症治疗的纳米级混合配体金属有机框架
摘要:
芝加哥大学林文斌老师等报道的本篇文章(J. Am. Chem. Soc. 2024)中设计了一种新型的混合配体纳米尺度金属-有机框架(nMOF),该材料能够在X射线照射下同时增强放疗效果并触发释放一种强力化疗药物。研究团队合成了一种新的功能性四苯基二甲酸配体(H2QP-SN),通过羟基自由基响应的共价键将SN38(一种有效的化疗药物)连接起来。由于QP-SN和双(p-苯甲酸)卟啉(DBP)配体长度相似,QP-SN被引入到Hf-DBP nMOF中,形成了一种新型多功能混合配体Hf-DBP-QP-SN nMOF,具有良好的生物相容性。Hf-DBP-QP-SN不仅通过独特的放疗-放射动力治疗(RT-RDT)过程增强对肿瘤的辐射损伤,还通过电子密集的Hf12次级构建单元(SBUs)增加·OH的生成,从而释放SN38进行化疗。在低剂量X射线照射下,Hf-DBP-QP-SN显著抑制了CT26结肠癌和4T1乳腺癌肿瘤的生长,且未观察到明显的全身毒性。
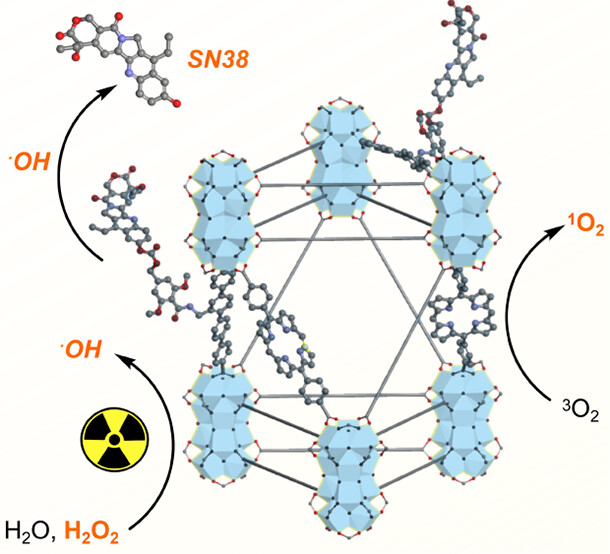
研究背景:
1) 传统的癌症治疗中,局部放疗和系统性化疗是标准治疗手段,但这些治疗方案在许多患者中会引起严重的副作用。
2) 为了降低化疗药物的全身毒性,许多研究者设计了刺激响应型纳米治疗系统,这些系统在目标部位激活以释放活性药物,刺激包括活性氧(ROS)、酶、温度和光等。
3) 本文作者设计了一种新型的混合配体nMOF,能够在X射线照射下同时增强放疗效果并触发化疗药物的释放。作者合成了新的四苯基二甲酸配体H2QP-SN,并将其与SN38通过羟基自由基响应的共价键连接,形成Hf-DBP-QP-SN nMOF,实现了在肿瘤微环境中的特异性化疗。
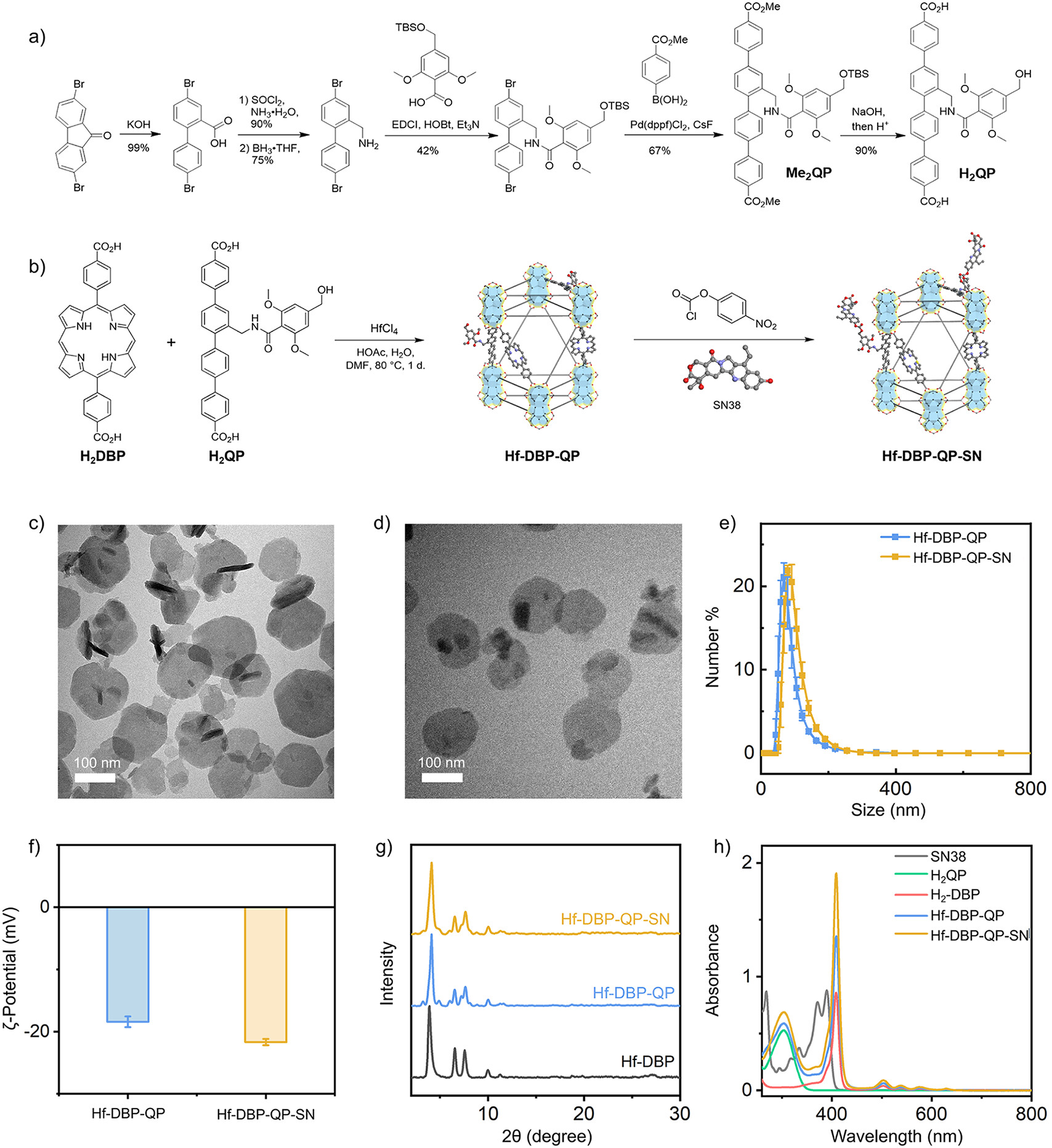
实验部分:
1. H2QP配体的合成:
1) 将3,5-二甲氧基苯甲醇和咪唑在二氯甲烷(DCM)中反应,加入叔丁基二甲基氯硅烷(TBSCl),室温搅拌2小时,甲醇(MetOH)淬灭过量的TBSCl,通过旋转蒸发浓缩,随后通过硅胶柱色谱纯化得到中间体2。
2) 中间体2在四氢呋喃(THF)中冷却至0°C,滴加正丁基锂(nBuLi),室温搅拌1小时,加入干冰(CO2),过夜后通过旋转蒸发浓缩,水相酸化至pH约3,过滤得到化合物3。
3) 化合物3与EDCI、HOBt和TEA在DCM中反应,加入(4,4'-二溴[1,1'-联苯]-2-基)甲胺(7),室温搅拌12小时,萃取、干燥、浓缩后通过柱色谱纯化得到化合物8。
4) 化合物8与(4-甲氧羰基苯基)硼酸在二氧六环中反应,加入CsF和Pd(dppf)Cl2催化剂,N2保护下90°C反应3天,过滤、浓缩、萃取后通过柱色谱纯化得到化合物9。
5) 化合物9在MeOH和H2O的混合溶剂中与NaOH反应,酸化至pH 1-2,过滤、洗涤、干燥后得到H2QP。
2. Hf-DBP-QP和Hf-DBP-QP-SN的合成:
1) 分别将HfCl4、H2DBP和H2QP-OH在DMF中溶解,混合后加入乙酸和水作为调节剂,80°C加热2天,离心、洗涤后分散在乙醇中储存得到Hf-DBP-QP。
2) Hf-DBP-QP在ACN中分散,加入4-硝基苯基氯甲酸酯和TEA,搅拌2天得到Hf-DBP-QP-NO2 nMOF,离心、洗涤后重新分散在ACN中,再加入SN38和TEA,搅拌2天得到Hf-DBP-QP-SN,洗涤后分散在EA中储存。
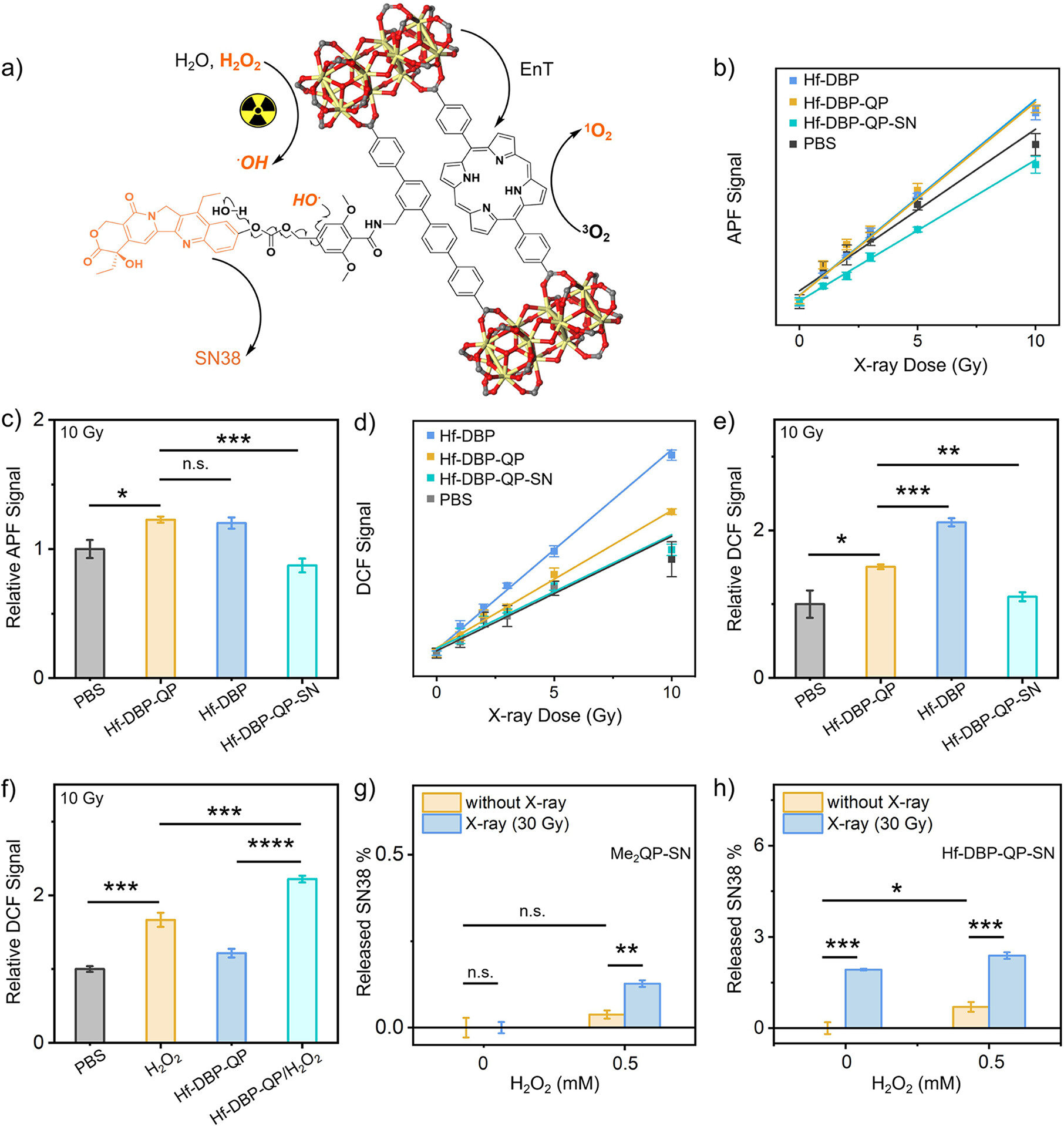
3. X射线触发的SN38释放实验:
1) Hf-DBP-QP-SN在PBS中分散,加入X射线剂量为30 Gy,加入乙酸乙酯(EA)后涡旋混合,离心后上清液通过LC-MS分析SN38的释放。
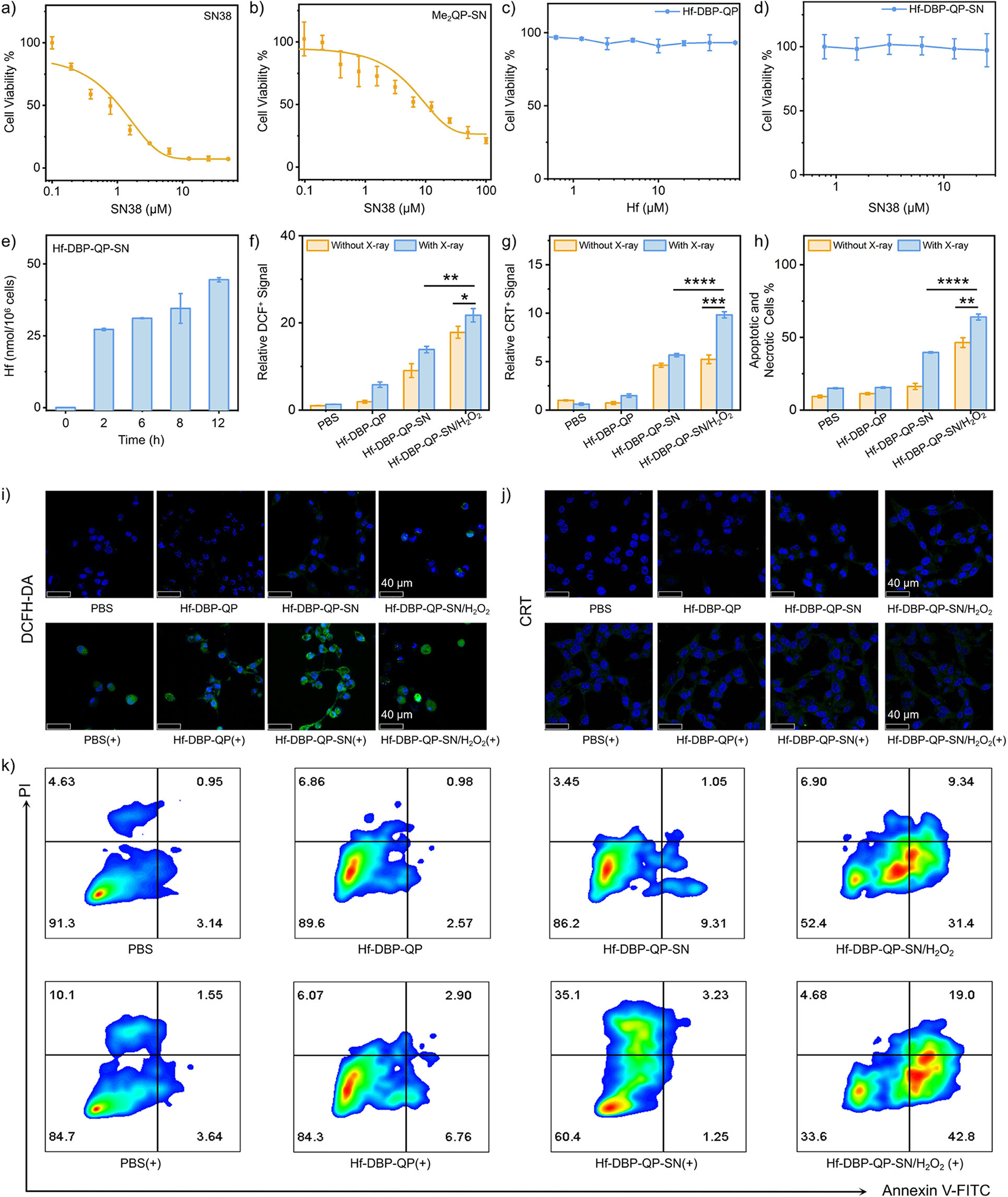
4. 细胞毒性实验:
1) CT26和4T1细胞在RPMI-1640培养基中培养,加入不同浓度的Hf-DBP-QP-SN,24小时后加入MTS试剂,再培养24小时,通过Synergy HTX酶标仪读取吸光度,计算细胞存活率。
5. 细胞摄取实验:
1) CT26细胞在6孔板中培养,加入Hf-DBP-QP-SN,不同时间点收集细胞,用硝酸消化后通过ICP-MS检测Hf浓度。
6. 细胞内ROS生成实验:
1) CT26细胞在培养皿中培养,加入DCFH-DA,再加入Hf-DBP-QP-SN/H2O2或Hf-DBP-QP-SN,X射线照射后,通过流式细胞仪和共聚焦激光扫描显微镜(CLSM)检测ROS生成。
分析测试:
1. 透射电子显微镜(TEM)表征:使用FEI Spirit 120kV LaB6电子显微镜进行Hf-DBP-QP和Hf-DBP-QP-SN的形态学表征。
2. 粉末X射线衍射(PXRD):使用Bruker D8 Venture衍射仪收集PXRD数据,使用Cu Kα辐射源(λ = 1.54178 Å),使用PowderX软件处理数据。
3. 紫外-可见(UV-Vis)光谱:使用Shimadzu UV-2600 UV-Vis分光光度计收集UV-Vis光谱。
4. 动态光散射(DLS)和ζ-电位测量:使用Malvern Zetasizer Nano ZS仪器进行DLS和ζ-电位测量。
5. 核磁共振(NMR)光谱:使用Bruker Ultrashield Plus谱仪在400 MHz下记录1H NMR光谱,以CDCl3或DMSO-d6为参照。
6. 高效液相色谱(HPLC)和液相色谱-质谱(LC-MS):使用Shimadzu Prominence UFLC/HPLC系统和Agilent 6540 LC-MS系统定量SN38浓度。
7. 质谱(HRA-MS)分析:使用Agilent 6224 Tof高分辨率准确质谱(HRA-MS)分析有机化合物。
8. X射线照射实验:使用RT250正电压X射线机模型(Philips, USA)和X-RAD 225图像引导生物辐照器(Precision X-ray Inc., USA)进行X射线照射实验。
9. 流式细胞仪数据:使用LSR-Fortessa 4-15 HTS (BD Biosciences, USA)收集流式细胞仪数据,使用FlowJo软件(Tree Star, USA)分析。
10. 共聚焦激光扫描显微镜(CLSM)图像:使用Leica Stellaris 8激光扫描显微镜收集CLSM图像,使用Image J软件(NIH, USA)分析。
11. 细胞活性和增殖实验:使用IncuCyte S3 (Essen BioScience)记录和分析活细胞图像。
12. 组织切片扫描和分析:使用CRi Pannoramic SCAN 40x全切片扫描仪扫描组织切片,使用QuPath 0.2.3软件分析。
13. 微孔板吸光度和荧光读取:使用BioTek Synergy HTX酶标仪读取微孔板的吸光度和荧光。
14. 细胞毒性实验结果:Hf-DBP-QP-SN对CT26和4T1细胞的细胞毒性实验结果显示,不同浓度的Hf-DBP-QP-SN处理后,细胞存活率显著降低,表明其具有良好的细胞毒性。
15. 细胞摄取实验结果:通过ICP-MS检测,CT26细胞对Hf-DBP-QP-SN的摄取随时间增加而增加,表明Hf-DBP-QP-SN能够被细胞有效摄取。
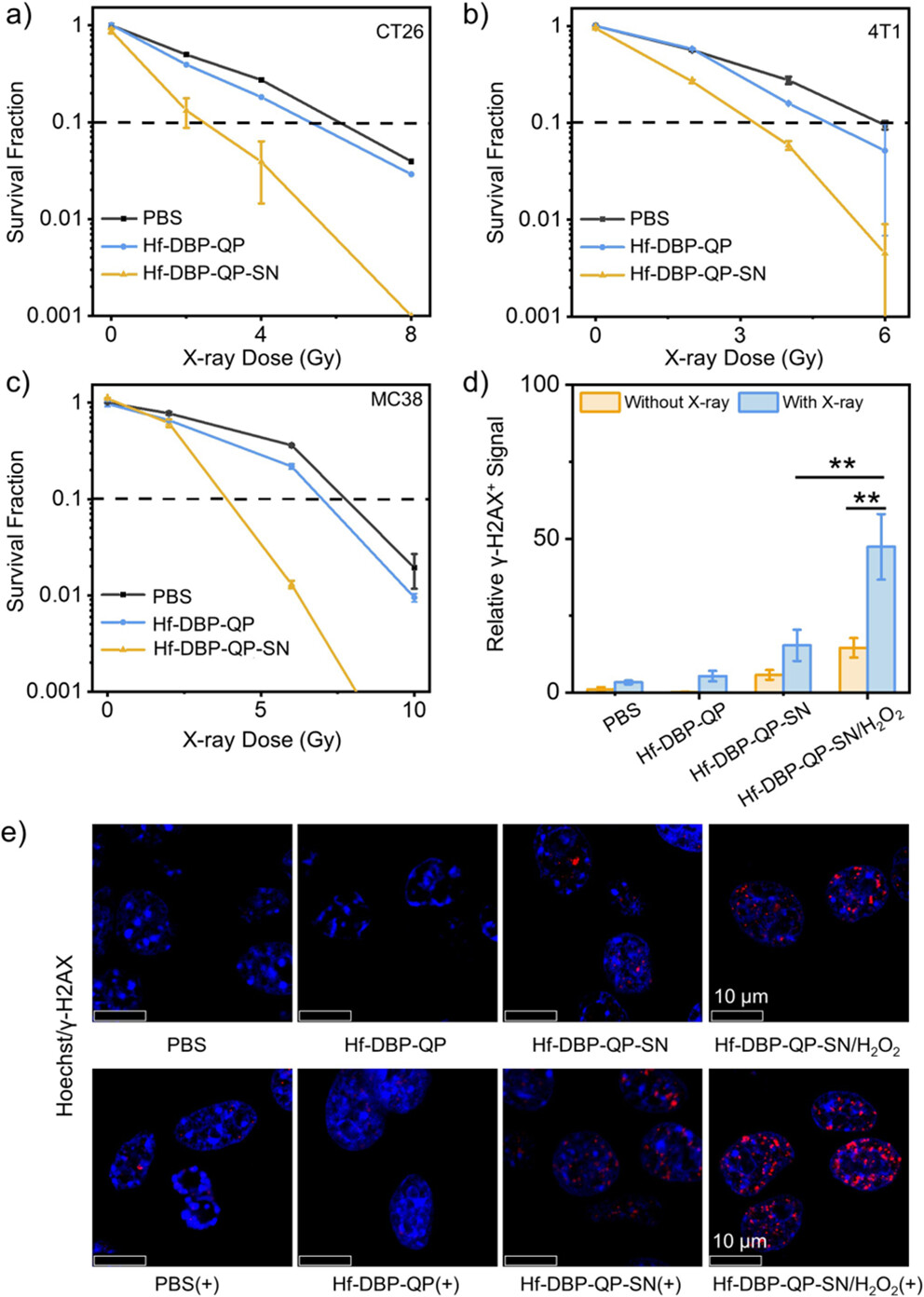
16. 细胞内ROS生成实验结果:流式细胞仪和CLSM实验结果表明,Hf-DBP-QP-SN处理的CT26细胞在X射线照射后,细胞内ROS水平显著升高,表明Hf-DBP-QP-SN能够增强细胞内ROS的生成。
17. X射线触发的SN38释放实验结果:LC-MS分析结果显示,Hf-DBP-QP-SN在X射线照射后能够显著释放SN38,且在存在H2O2的情况下释放量更高,表明X射线能够触发Hf-DBP-QP-SN中SN38的释放。
总结:
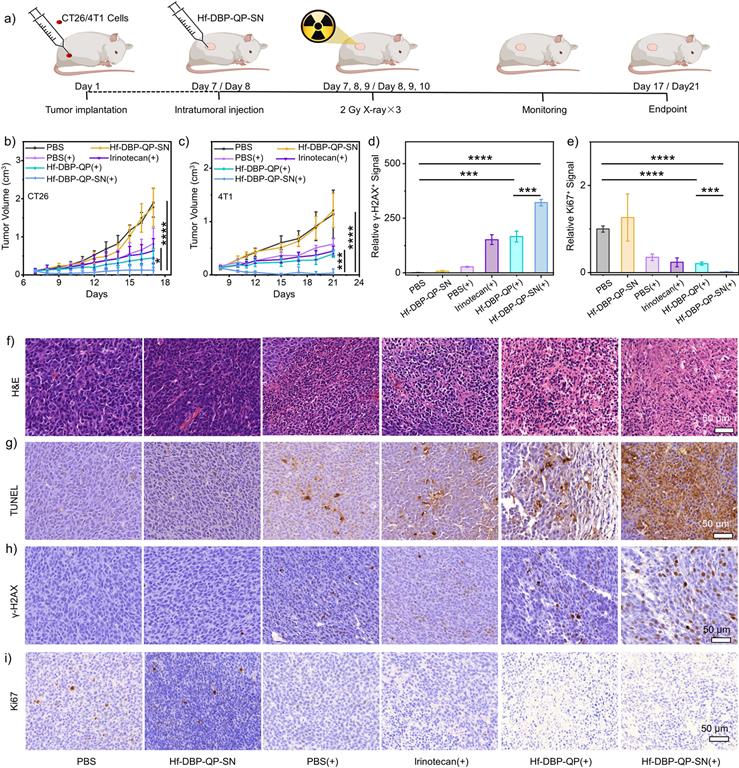
本文成功设计了一种新型的混合配体nMOF,Hf-DBP-QP-SN,它能够在X射线照射下增强放疗效果并触发化疗药物SN38的释放。通过体外和体内实验,证明了Hf-DBP-QP-SN在低剂量X射线照射下显著抑制了CT26结肠癌和4T1乳腺癌肿瘤的生长,且未引起明显的全身毒性。
展望:
本研究的积极影响在于提供了一种新的癌症治疗策略,即通过X射线触发的纳米药物释放来实现放疗和化疗的协同效应。未来的研究可以进一步探索Hf-DBP-QP-SN在其他类型的癌症治疗中的应用,以及优化X射线触发的药物释放效率和剂量控制,以实现更加精准和有效的癌症治疗。此外,还可以研究Hf-DBP-QP-SN的长期生物相容性和潜在的毒副作用,以确保其在临床应用中的安全性。
Nanoscale Mixed-Ligand Metal−Organic Framework for X‑ray Stimulated Cancer Therapy
文章作者:Wenyao Zhen, Ziwan Xu, Yibin Mao, Caroline McCleary, Xiaomin Jiang, Ralph R. Weichselbaum, and Wenbin Lin*
DOI:10.1021/jacs.4c12140
文章链接:https://pubs.acs.org/doi/10.1021/jacs.4c12140
本文为科研用户原创分享上传用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。





