首页 >
行业动态 > S-掺杂铁三唑盐金属-有机框架纳米酶:配体工程高效过氧化物酶模拟物
S-掺杂铁三唑盐金属-有机框架纳米酶:配体工程高效过氧化物酶模拟物
摘要:
河北大学杨魁和温嘉老师等报道的本篇文章(Chem. Mater. 2024)中通过配体调控策略制备了一类基于金属有机框架(MOF)的纳米酶。首先,通过溶剂热法合成了具有Fe-N结构的铁三唑(MET(Fe))纳米酶。然后,通过混合配体生长法引入不同比例的含硫配体,制备了一系列硫掺杂的MET(Fe)(S-MET(Fe))纳米酶。研究发现,含硫配体会与Fe竞争性配位,形成“-C-SOx”键,导致更多的氧缺陷,从而增强了催化活性。作为概念验证,1/3-S-MET(Fe)纳米酶因其出色的过氧化物酶样活性被用于生物传感和细菌消除。本研究为设计和构建高活性纳米酶提供了新思路。
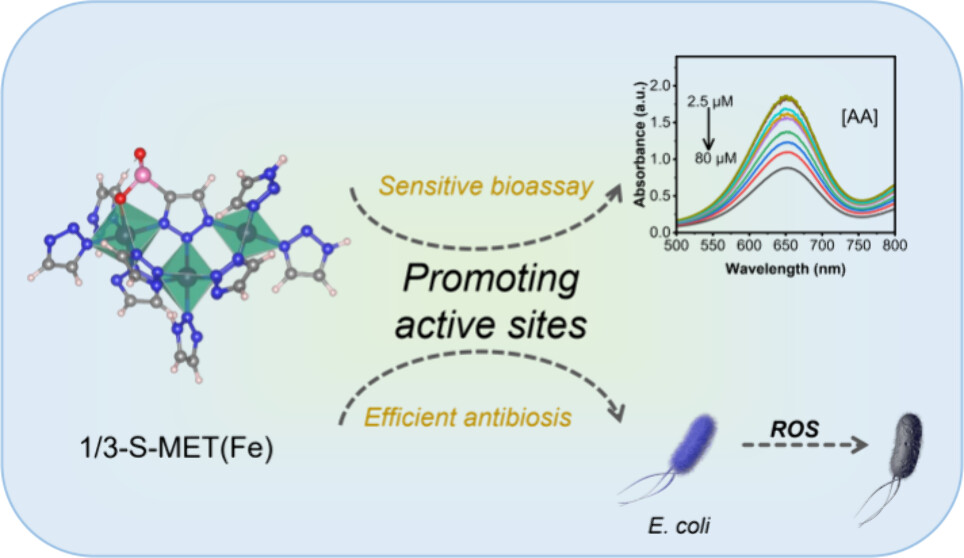
研究背景:
1) MOF基纳米酶因其高比表面积和有序孔结构在生物催化领域受到广泛关注,但其催化活性与天然酶相比仍不理想,需要探索简单有效的提高MOF基纳米酶催化活性的方法。
2) 已有研究表明,金属掺杂是调整纳米酶结构和催化活性的有效方法,通过影响表面电子结构和能带结构来调节催化性能。
3) 本文作者通过引入含硫配体,利用配体工程策略调控MOF基纳米酶的催化活性,制备了S掺杂的MET(Fe)纳米酶,并详细研究了其过氧化物酶样催化活性和机制。
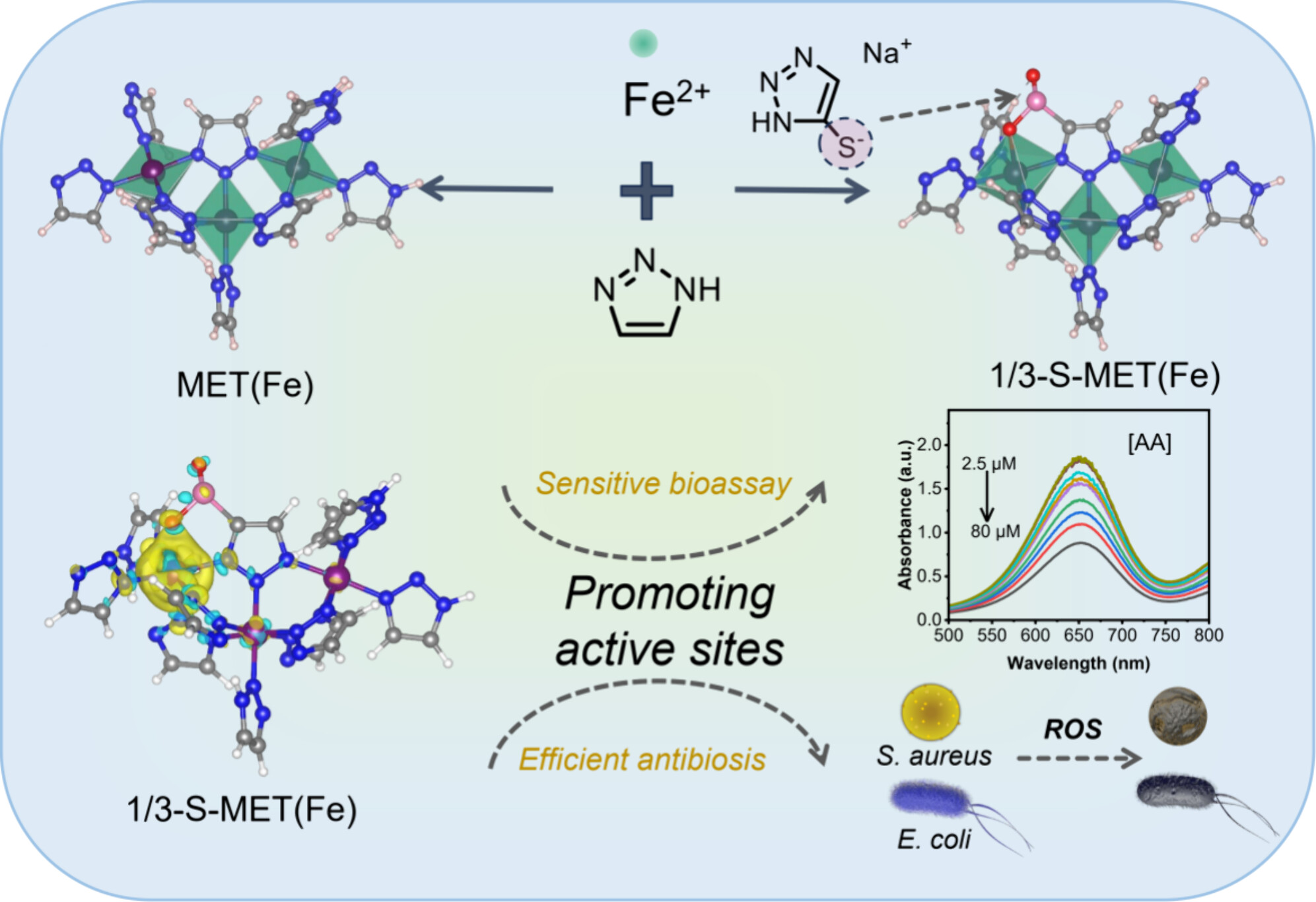
实验部分:
1. MET(Fe)和S-MET(Fe)纳米酶的合成
-操作步骤:
1. 将14毫升N,N-二甲基甲酰胺(DMF)加入到压力瓶中,用氮气冲洗20分钟。
2. 将FeCl2·4H2O(160毫克)溶解在DMF中,超声分散。
3. 根据表S1的比例,向所得溶液中加入1H-1,2,3-三唑或钠1,2,3-三唑-5-硫醇和1H-1,2,3-三唑的混合物。
4. 再次超声分散后,在120°C下搅拌24小时。
5. 通过离心分离产物,并用DMF和甲醇多次洗涤,最后在真空中干燥。
2. 催化活性研究
-操作步骤:
1. 向HAc-NaAc缓冲液(pH 4.0)中加入MET(Fe)或1/3-S-MET(Fe)纳米酶(5.0 μg/mL)。
2. 在存在TMB(0.2 mM)和H2O2(0.2 mM)的条件下,孵化10分钟。
3. 用紫外-可见光谱法检测所得混合物在652 nm处的吸光度。
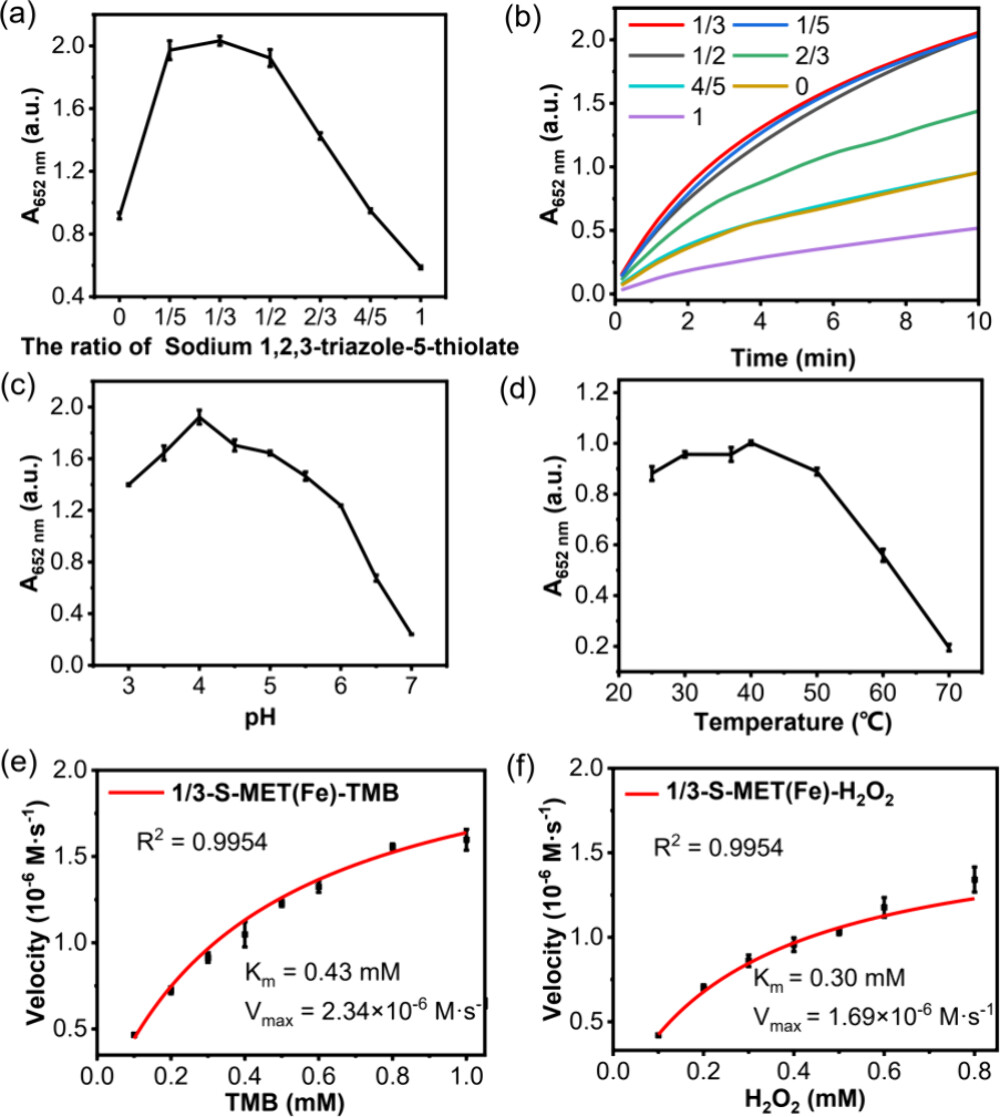
3. 测试条件优化
-操作步骤:
1. 在不同温度下,将MET(Fe)或1/3-S-MET(Fe)纳米酶加入到HAc-NaAc缓冲液(0.2 M, pH 4.0)中,并与TMB和H2O2一起孵化15分钟。
2. 在不同pH值下,将MET(Fe)或1/3-S-MET(Fe)纳米酶加入到HAc-NaAc缓冲液(0.2 M)中,并与TMB和H2O2一起在25°C下孵化20分钟。
4. 纳米酶的动力学测试
-操作步骤:
1. 在最佳条件下,使用不同浓度的TMB(固定H2O2浓度为1.5 mM)或不同浓度的H2O2(固定TMB浓度为2.0 mM的MET(Fe)纳米酶和1.0 mM的1/3-S-MET(Fe)纳米酶)进行动力学测试。
2. 在652 nm处进行时间扫描模式下的动力学测试,并使用Michaelis-Menten方程计算Vmax和Km值。
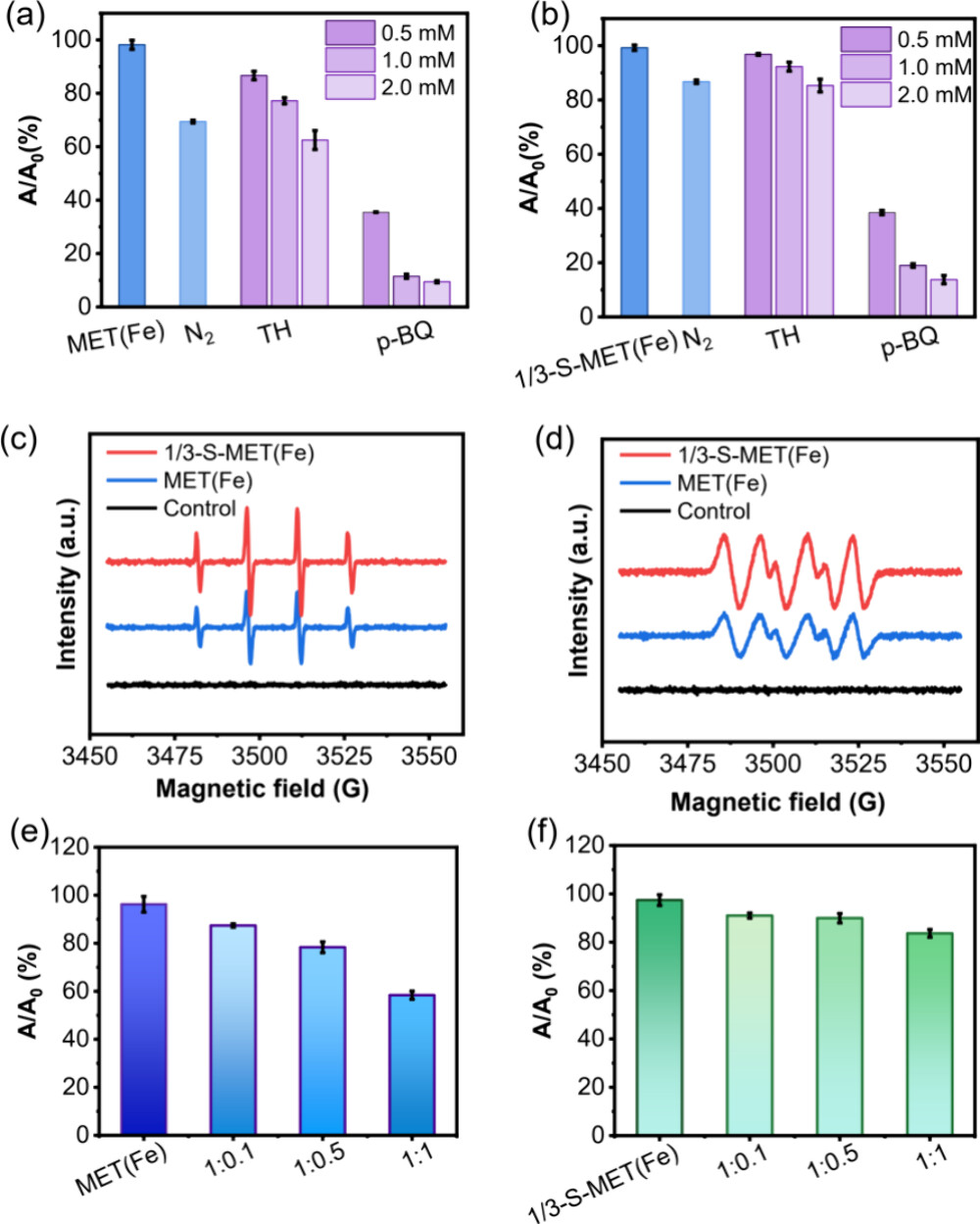
5. ROS的测定
-操作步骤:
1. 向HAc-NaAc缓冲液(pH 4.0)中加入MET(Fe)或1/3-S-MET(Fe)纳米酶、TMB和H2O2。
2. 分别加入0.5、1.0和2.0 mM的ROS清除剂(TH和p-BQ)。
3. 在25°C下孵化10分钟,并通过紫外-可见光谱光度计监测652 nm处的吸光度。
6. DFT计算
-操作步骤:
1. 使用CP2K代码进行所有DFT计算。
2. 使用混合高斯和平面波基组进行计算。
3. 在所有计算中,添加DFT-D3方案以补偿吸附剂和骨架之间的长距离范德华色散相互作用。
7. 基于1/3-S-MET(Fe)纳米酶的AA检测
-操作步骤:
1. 向HAc-NaAc缓冲液(0.2 M, pH 4.0)中加入1/3-S-MET(Fe)纳米酶(10 μg/mL)、TMB(0.2 mM)、H2O2(0.2 mM)和不同浓度的AA(2.50−80.0 μM)。
2. 在25°C下水浴中孵化10分钟,检测反应系统在652 nm处的吸光度。
8. 抗菌实验
-操作步骤:
1. 使用大肠杆菌和金黄色葡萄球菌作为模型,通过平板涂层法测定纳米酶的抗菌效果。
2. 将细菌溶液加入到不同的离心管中,包括对照组、MET(Fe)纳米酶、1/3-S-MET(Fe)纳米酶、H2O2、MET(Fe)纳米酶+H2O2和1/3-S-MET(Fe)纳米酶+H2O2。
3. 在37°C下孵化2小时,然后将处理过的细菌溶液稀释,并均匀涂抹在固体培养基表面,37°C过夜培养。
分析测试:
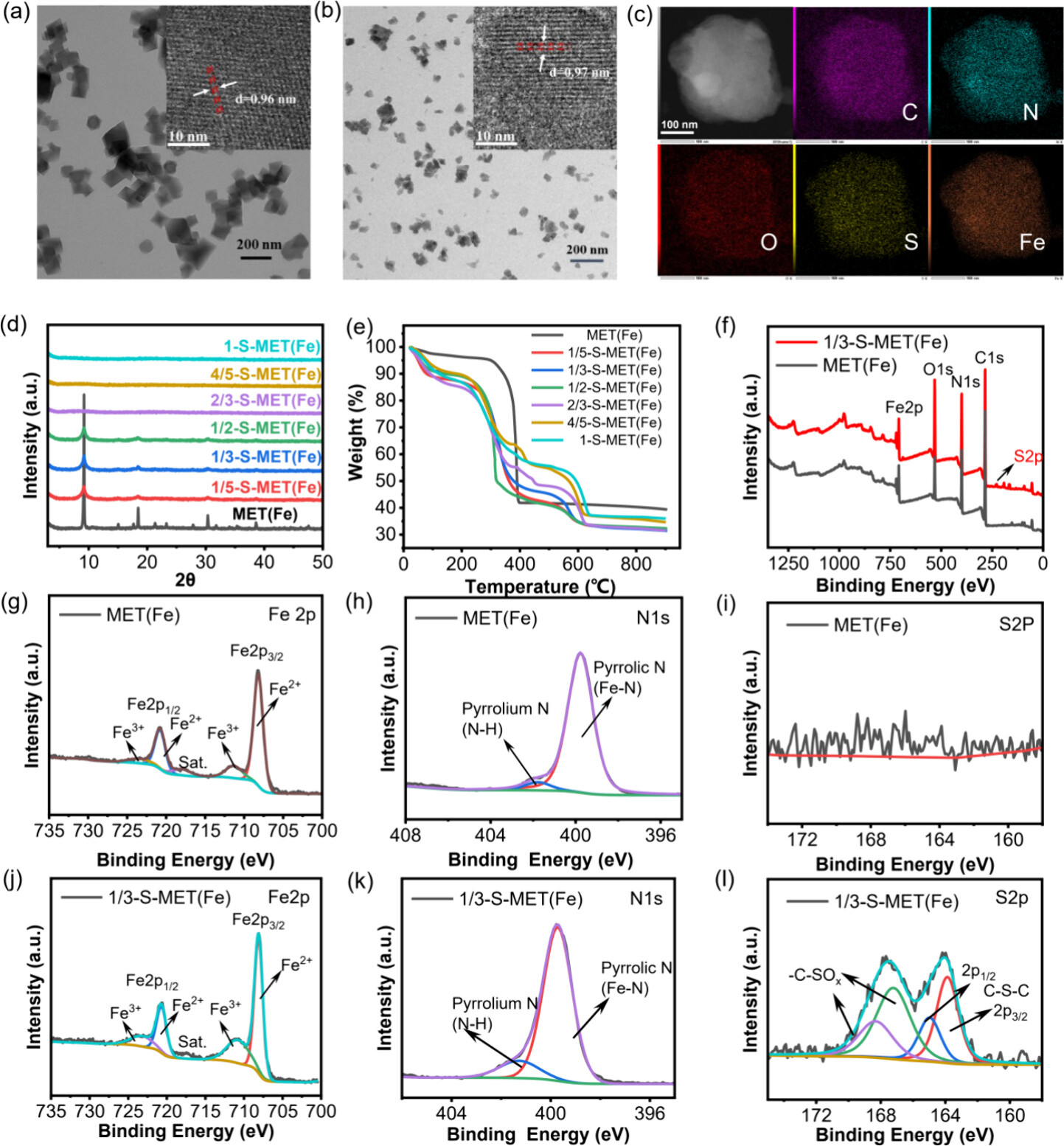
1. 透射电子显微镜(TEM)
-测试结果:
- MET(Fe)呈现八面体结构,尺寸约为100−130 nm。
- 1/3-S-MET(Fe)尺寸较小,约为50−60 nm。
2. 粉末X射线衍射(PXRD)
-测试结果:
- MET(Fe)的衍射峰与文献报告一致,S掺杂后衍射峰位置未移动,但衍射峰强度逐渐降低。
3. 热重分析(TGA)
-测试结果:
- MET(Fe)纳米酶骨架结构在约300°C时崩塌。
- S-MET(Fe)纳米酶在约240°C开始崩塌,表明S掺杂降低了骨架结构的热稳定性。
4. X射线光电子能谱(XPS)
-测试结果:
- 1/3-S-MET(Fe)纳米酶的Fe 2p的结合能高于MET(Fe)纳米酶,表明S掺杂改变了电子效应的强度。
- 1/3-S-MET(Fe)纳米酶中Fe的电子密度降低,可能调节了纳米酶的催化行为。
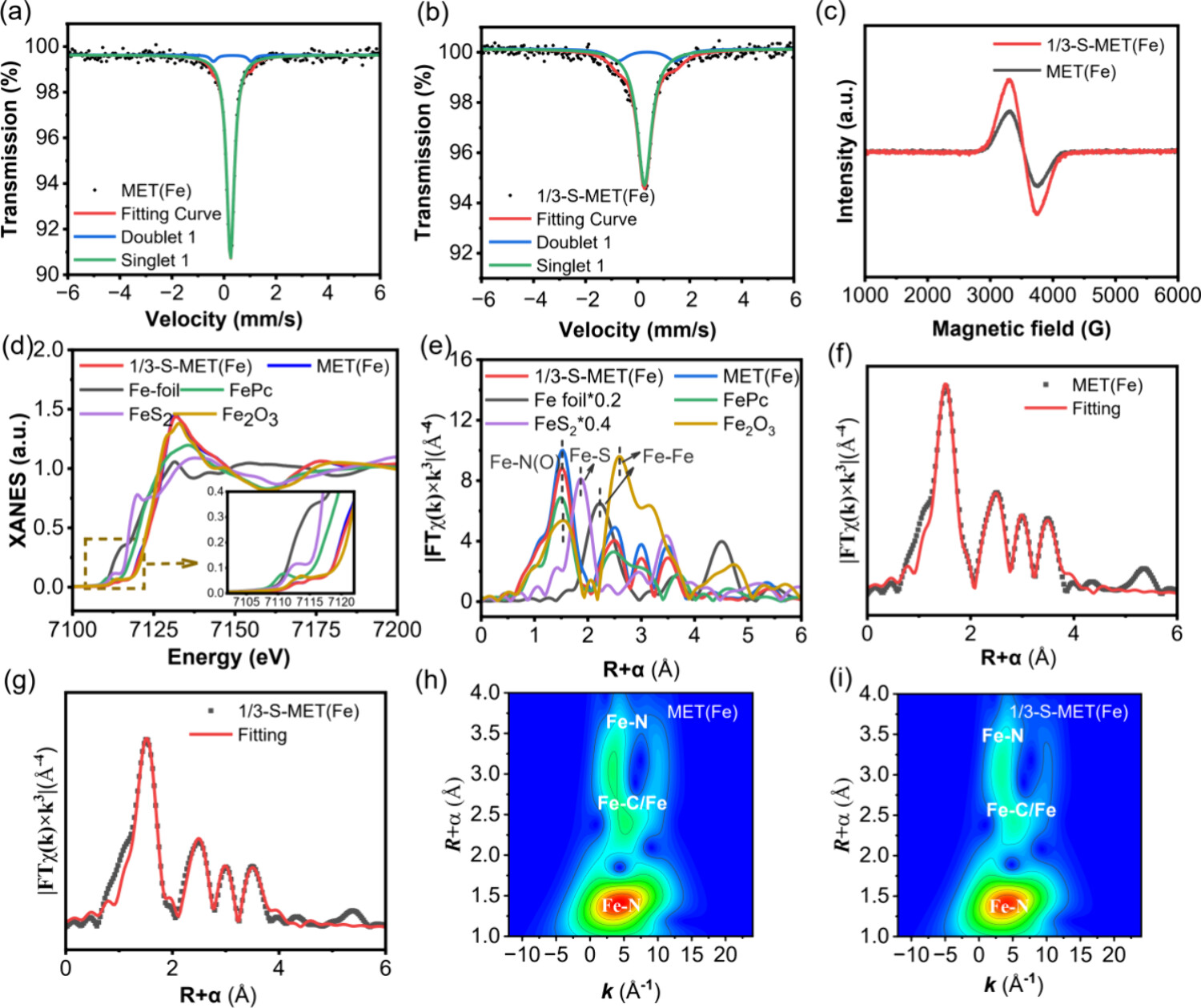
5. 穆斯堡尔光谱
-测试结果:
- MET(Fe)纳米酶中Fe物种的IS和QS参数表明,单重态属于低自旋FeII,双重态属于低自旋FeIII。
- 1/3-S-MET(Fe)纳米酶中,单重态和双重态分别属于低自旋FeII和中等自旋FeIII。
6. 电子顺磁共振(EPR)
-测试结果:
- 1/3-S-MET(Fe)纳米酶产生了更强烈的共振信号,表明S掺杂引入了更多缺陷,提供了更多催化位点。
7. X射线吸收光谱(XAS)
-测试结果:
- Fe的价态在MET(Fe)和1/3-S-MET(Fe)纳米酶中介于0和+3之间。
- Fe-N键的形成在MET(Fe)和1/3-S-MET(Fe)纳米酶中得到确认,Fe-N的配位数(CN)分别为6.0±0.5和5.9±0.5,距离分别为1.96 Å和1.97 Å。
8. 循环伏安测试
-测试结果:
- 1/3-S-MET(Fe)纳米酶对AA的检测限为1.072 μmol/L。
9. 抗菌活性测试
-测试结果:
- 1/3-S-MET(Fe)纳米酶在H2O2存在下能有效抑制大肠杆菌和金黄色葡萄球菌的生长。
总结:
本文通过配体工程策略成功制备了S掺杂的MET(Fe)纳米酶,其中1/3-S-MET(Fe)纳米酶展现出优异的过氧化物酶样活性。通过精细结构分析,发现S掺杂影响了Fe催化中心,产生了中等自旋的FeIII物种和更多的配位缺陷,从而提高了纳米酶的催化活性。此外,1/3-S-MET(Fe)纳米酶还展现出对AA的灵敏检测能力,检测限为1.072 μmol/L,并且对大肠杆菌和金黄色葡萄球菌具有出色的抗菌活性。
展望:
本研究为MOF基纳米酶的设计与构建提供了新的思路,特别是通过配体工程策略调控催化活性。未来的研究可以进一步探索不同掺杂元素对MOF基纳米酶性能的影响,以及这些纳米酶在生物医学领域的应用潜力。此外,还可以研究这些纳米酶在实际环境条件下的稳定性和长期效应,以及它们对生态系统的潜在影响。
S‑Doped Iron-Triazolate Metal−Organic Framework Nanozymes: Ligand-Engineered High-Efficiency Peroxidase Mimics
文章作者:Lanlan Chen, Chen Wang, Kui Yang,* Tianyi Li, and Jia Wen*
DOI:10.1021/acs.chemmater.4c02213
文章链接:https://pubs.acs.org/doi/10.1021/acs.chemmater.4c02213
本文为科研用户原创分享上传用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。





